
题目列表(包括答案和解析)
A.Zn为正极,碳为负极
B.Zn为负极,碳为正极
C.工作时电子由碳极,经外电路流向Zn极
D.长时间连续使用时内装糊状物可能流出腐蚀用电器
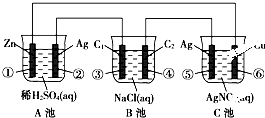 已知金属活动相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:
已知金属活动相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题: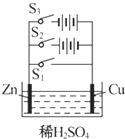 根据右图,回答下列问题:
根据右图,回答下列问题: 在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图:
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com