
题目列表(包括答案和解析)

收集气体
图2-13
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2
(1)若烧瓶是干燥的,则由B口进气可收集的气体有__________(写序号)。
(2)若烧瓶充满水,可收集的气体有__________,这时气体由__________口进入。
(3)若烧瓶是干燥的,则由A口进气,可收集的气体有__________。
(4)若在烧瓶内装入浓硫酸进行气体干燥,则可用此装置干燥的气体有__________,这时气体由__________口进入。
利用图1-5-13所示装置(暂不考虑尾气的吸收),选用中学化学常见试剂设计两个实验,将所用试剂名称、丙中现象及由此得出的实验结论(可以是单一物质的性质,也可以是不同物质性质比较)填入下列空白处:

图1-5-13
(1)[实验一]
所用试剂:甲__________、乙__________、丙__________。
丙中现象:____________________________________________________________。
实验结论:____________________________________________________________。
(2)[实验二]
所用试剂:甲__________、乙__________、丙__________。
丙中现象:____________________________________________________________。
实验结论:____________________________________________________________。
某研究小组利用题9图装置探究温度对CO还原Fe2O3的影响(固定装置略)
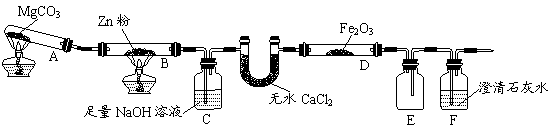
题9图
(1)MgCO3的分解产物为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按题9图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 取步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ,溶液褪色可能的原因及其验证方法为 。
④从实验安全考虑,题9图装置可采取的改进措施是 。

收集气体
图2-13
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2
(1)若烧瓶是干燥的,则由B口进气可收集的气体有__________(写序号)。
(2)若烧瓶充满水,可收集的气体有__________,这时气体由__________口进入。
(3)若烧瓶是干燥的,则由A口进气,可收集的气体有__________。
(4)若在烧瓶内装入浓硫酸进行气体干燥,则可用此装置干燥的气体有__________,这时气体由__________口进入。



1
2
3
4
5
6
C
B
D
D
D
C
7
8
9
10
11
12
C
B
C
B
A
C
13
14
15
16
17
18
B
B
D
A
C
A
19
20
21
22
23
24
A
D
B
A
D
B
25、氧化剂:KMnO4 还原剂:HCl 质量比:316∶511
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com