
题目列表(包括答案和解析)
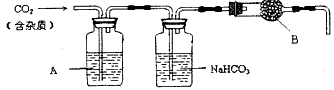
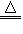 MnCl2+Cl2↑+2H2O 据此,从下列所给仪器装置中选择制备并收集H2的装置__________(填代号)和制备并收集干燥、纯净Cl2的装置___________(填代号)。可选用制备气体的装置
MnCl2+Cl2↑+2H2O 据此,从下列所给仪器装置中选择制备并收集H2的装置__________(填代号)和制备并收集干燥、纯净Cl2的装置___________(填代号)。可选用制备气体的装置
(13分)食盐是日常生活的必需品,也是重要的化工原料。
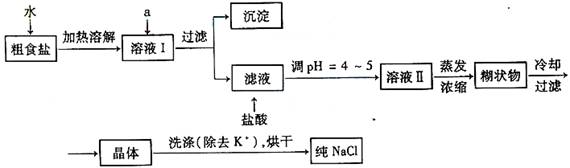
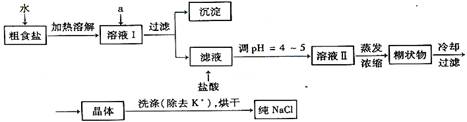
⑴粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 四氯化碳
欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 。(只填化学式)
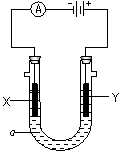 ⑵用提纯的NaCl配制500mL4.00 mol?L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有
⑵用提纯的NaCl配制500mL4.00 mol?L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有
(填仪器名称)。
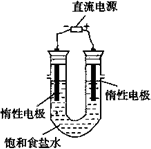
⑶电解饱和食盐水的装置如图所示,如果在饱和食盐水中滴加酚酞,通电后 (填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式 。
⑷实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑ MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
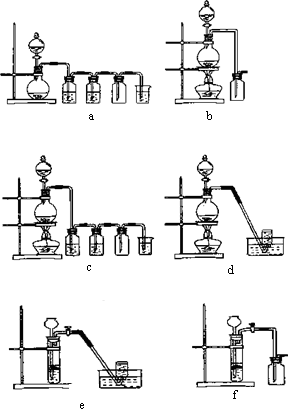
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置: 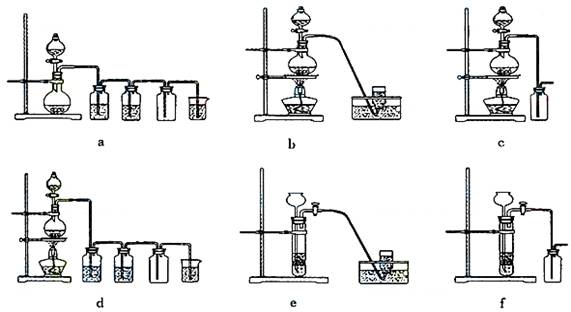
(16分)食盐是日常生活的必需品,也是重要的化工原料。
⑴粗食盐常含少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl流程如下:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、CCl4
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 (只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 。
⑵用提纯的NaCl配制500mL4.00mol?L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有 (填仪器名称)。
⑶电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的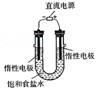 Cl2 2L (填“>”、“=”或“<”),原因是 。
Cl2 2L (填“>”、“=”或“<”),原因是 。
装置改进后,可制备NaOH溶液,若测定溶液中NaOH浓度,常用方法为 。
⑷实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑ MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从上述所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置: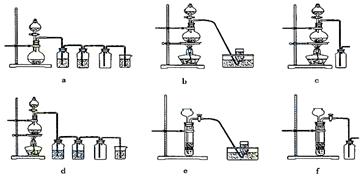
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO![]() 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
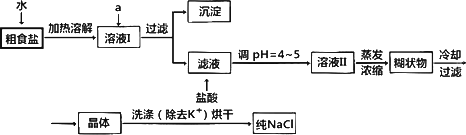
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO![]() 离子,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
离子,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________.
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除天平、药匙、玻璃棒外还有________(填仪器名称).
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2________(填“>”、“=”或“<”)2 L,原因是________.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是________.

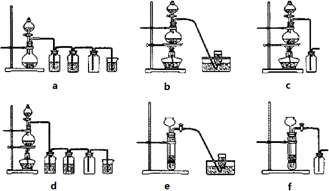
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4![]() ZnSO4+H2↑;MnO2+4HCl(浓)
ZnSO4+H2↑;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置________________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).
可选用制备气体的装置:
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
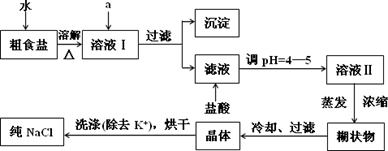
提供的试剂:饱和Na2CO3溶液,饱和K2CO3溶液,NaOH溶液,BaCl2溶液,Ba(NO3)2溶液,75%乙醇,四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________.
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1的NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称).
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2________(填“>”“=”或“<”)2 L,原因是________.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为________.
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4![]() ZnSO4+H2↑;MnO2+4HCl(浓)
ZnSO4+H2↑;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).可选用制备气体的装置:
MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).可选用制备气体的装置:
1、B 2、 C 3、A 4、B 5、 C
6、C 7、B 8、C 9、B 10、C 11、D 12、D 13、A
14.BD 15.B 16.C 17.B 18.D 19.C 20.D 21. BD
第Ⅱ卷(非选择题,共10大题,共174分)
22. (18分)答案: 
(2)①在右边方框中画出实验电路图(9分)
 |
②mA表内阻RA= 80  。(78Ω~82Ω均算正确)(3分)
。(78Ω~82Ω均算正确)(3分)
23.(14分)
解:车的加速度大小由牛顿第二定律知:
所以  (3分)
(3分)
设刹车过程中车的位移为s′,则:
 (3分)
(3分)
刹车过程中车的位移为: ………(2分)
………(2分)
当  时,车停在标志杆处,车距标志杆的距离
时,车停在标志杆处,车距标志杆的距离
 ………(2分)
………(2分)
当  时,车还没达到标志杆处,车距标志杆的距离
时,车还没达到标志杆处,车距标志杆的距离
 (2分)
(2分)
当 时,车已经驶过标志杆,车距标志杆的距离
时,车已经驶过标志杆,车距标志杆的距离
 (2分)
(2分)
24.解:(1) 根据带电小球A恰能做完整的圆周运动,因 ,则小球能通过复合场中的最高点P(如图)设经过轨道上的P点的速度为v,由小球A的重力和电场力的合力提供向心力有:
,则小球能通过复合场中的最高点P(如图)设经过轨道上的P点的速度为v,由小球A的重力和电场力的合力提供向心力有:

 …………①
…………①
在圆周轨道的最低点弹簧将B、A两球向左、右弹开,设弹开时A、B两球的速度大小分别为vA、vB,由动量守恒有:
 ,即
,即 …………②
…………②
小球A从圆周轨道的最低点运动到P的过程中,由动能定理有:
 …③
…③
由①②③求得:
(2)设BC碰后速度为v1 , B与C碰撞动量守恒
 得v1=
得v1=
BC整体减速,D球加速,当两者速度相等时设为v2,弹簧最短,弹性势能最大
 得v2=
得v2= m/S ……⑤
m/S ……⑤
EP m= ……⑥
……⑥
25.解:(1)线框下落阶段进入磁场做匀速运动,令此时的速度为v2,则有
mg=F安+f ①(2分)
其中F安=BIa, ②(2分)
故此 (2分)
得 (2分)
(2)令线框离开磁场向上升的阶段加速度为a上,从最高点落至磁场过程中下降的加速度为a下,则必有
④(3分)
而a1=(mg+f )/m,a2=(mg-f )/m ⑤(2分)
代入计算有 (3分)
(3)由功能关系对线框进入到离开磁场有(4分)
故 (2分)
|