
题目列表(包括答案和解析)
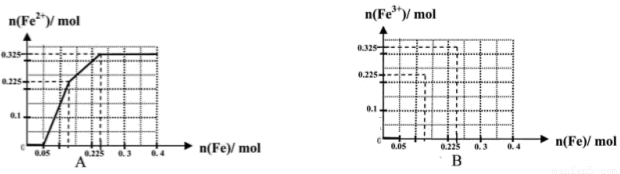
(一)(8分)在含有物质的量各为0.1 mol FeCl3、H2SO4、Cu(NO3)2的溶液500 mL中,逐渐加入铁粉,溶液中n(Fe2+)与加入n(Fe)的关系如图A(请注意识图,该题图中每小正方格长度为0.05mol)。(提示:忽略离子水解产生的影响;如果有硝酸根被还原时,则生成一氧化氮气体)
(1)写出图中n(Fe)从0.125mol-0.225 mol段对应反应的离子方程式____。
(2)写出图中n(Fe)从0-0.05 mol段对应反应的离子方程式____。
(3)请在图B中画出溶液中n(Fe3+)与加入n(Fe)的变化关系图
(4)当反应进行到最后,取该溶液2mL加入试管中,为了证明该溶液中有NO3-存在,可以向试管中在滴加_______。
A.酸性KMnO4溶液??? B.含有盐酸的KSCN溶液??? C.碘水??? D.次氯酸钠溶液
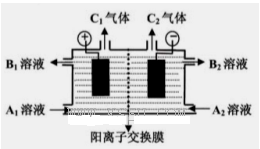
(二)(5分)下图是电解槽的剖面图,箭头的方向指的是气体或溶液的流向,阳离子交换膜只允许阳离子通过。现要用此装置来通过电解分离Na2SO4和NaOH的混合溶液,则向装置中通入A1溶液和A2溶液(A1溶液是Na2SO4和NaOH的混合溶液,A2溶液是NaOH的稀溶液)。电解一段时间后,装置中流出:B2溶液(是NaOH的浓溶液)和B1溶液,C1气体和C2气体。
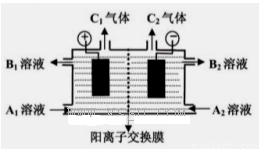
(1) C2气体是______(填化学式)。
(2)请写出阳极反应的电极方程式???????????????????????????????? .
(3)请简述阴极室能流出NaOH的浓溶液的原因????????????????????????? .
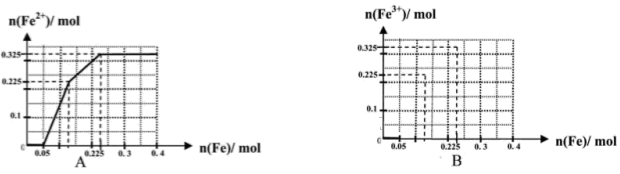
(一)(8分)在含有物质的量各为0.1 mol FeCl3、H2SO4、Cu(NO3)2的溶液500 mL中,逐渐加入铁粉,溶液中n(Fe2+)与加入n(Fe)的关系如图A(请注意识图,该题图中每小正方格长度为0.05mol)。(提示:忽略离子水解产生的影响;如果有硝酸根被还原时,则生成一氧化氮气体)
(1)写出图中n(Fe)从0.125mol-0.225 mol段对应反应的离子方程式____。
(2)写出图中n(Fe)从0-0.05 mol段对应反应的离子方程式____。
(3)请在图B中画出溶液中n(Fe3+)与加入n(Fe)的变化关系图
(4)当反应进行到最后,取该溶液2mL加入试管中,为了证明该溶液中有NO3-存在,可以向试管中在滴加_______。
| A.酸性KMnO4溶液 | B.含有盐酸的KSCN溶液 | C.碘水 | D.次氯酸钠溶液 |
| A.酸性KMnO4溶液 | B.含有盐酸的KSCN溶液 | C.碘水 | D.次氯酸钠溶液 |


(18分)现有五种可溶性物质A、B、C、D、E, 它们所含的阴、 阳离子互不相同,分别含有五种阳离子 Na+、Al3+、Mg2+、Ba2+、Fe3+ 和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是 和_______(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴人稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为____。
A.SO32- B.SO42- C.CH3COO- D.SiO32-
(3)B的水溶液显___性,原因为____。(用离子方程式表示)
(4)将0.02 molA与0.0 1molC同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为________(保留一位小数)。
(5)将Cu投人到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的_____(填相应的离子符号)。有关反应的离子方程式为:____________。
(6)利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论_________________。
(18分)现有五种可溶性物质A、B、C、D、E, 它们所含的阴、 阳离子互不相同,分别含有五种阳离子 Na+、Al3+、Mg2+、Ba2+、Fe3+ 和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是 和_______(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴人稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为____。
A.SO32- B.SO42- C.CH3COO- D.SiO32-
(3)B的水溶液显___性,原因为____。(用离子方程式表示)
(4)将0. 02 molA与0.0 1molC同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为________(保留一位小数)。
(5)将Cu投人到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的_____(填相应的离子符号)。有关反应的离子方程式为:____________。
(6)利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论_________________。
说明:1. 文字简答题以关键词到位为准,按点给分;
2. 化学用语书写:(1)方程式未配平不得分、无条件扣一半分值;
(2)化学式书写错误得0分;
3. 写名称或化学式正确的正常给分; 4. 其他合理解法正常给分。
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
A
C
B
D
A
B
D
B
AC
C
A
BD
D
AD
第Ⅱ卷(非选择题 共72分)
三、(本题包括1小题,共10分)
15.(10分)(1)NH4[CuCl2] =CuCl↓+NH4Cl(1分),避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分(1分)。(2)蒸馏(1分),NH4Cl、HNO3(2分)。 (3) B(2分) (4)氯化铵溶于水吸收大量热量,造成反应液温度降低(1分)。 烧瓶上方红棕色气体逐渐变为无色(1分),a或c(1分)(答a或答c给分)
四、(本题包括2小题,共18分)
16.(8分)(1)六 ⅣA (各1分,共2分)(2)不变(2分)
(3) Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O (2分)
(4)Na2S2O3标准溶液浓度和滴定溶液体积(2分)
17.(10分)(1)CH4+H2O
 CO+3H2(2分)(2)n (2分)(3)Fe2O3?H2O(2分)
CO+3H2(2分)(2)n (2分)(3)Fe2O3?H2O(2分)
 |
(4) 优点是:NaOH可以循环利用,同时获得副产品氢气。(各2分,共4分,优点答到“NaOH可以循环利用”即可)
五、(本题包括1小题,共10分)
18.(10分)(1)氯化铵(2分)
(2)原因是降低KH2PO4溶解度,使其析出后,降低了生成物浓度,(同时生成的HCl与三正丁胺反应,也降低了HCl的浓度),使平衡向正反应方向移动。(2分,答到一点即可)。分离出氯化氢(2分,其他合理答案均给分)(3)50―60均可,95%(填近似值即可)(各2分,共4分)
六、(本题包括1小题,共12分)
19.(12分)(1)与生成的硫酸反应,促进平衡向正反应方向移动。(2分)
(2) (2分)
(2分)
(3)2(1分)
(4) (2分)
(2分)
(5)保护A中的酚羟基。(2分)
(6)(3分,第一步正确得2分,完全正确得3分)

|