
题目列表(包括答案和解析)
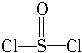 )中形成的,电池总反应方程式为:8Li+3SOCl2
)中形成的,电池总反应方程式为:8Li+3SOCl2A.若电解质溶液中混入水,对电池反应无影响?
B.金属锂作电池的正极,石墨作电池的负极?
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为S?
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1?
A.电解质溶液中混入碱溶液,对电池反应无影响
B.电池的正极为:Li-e-![]() Li+
Li+
C.电池工作过程中,亚硫酰氯(SOCl2)仅被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,SOCl2被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出的S的物质的量之比为4∶1
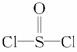 )中而形成的,电池总反应方程式为8Li+3SOCl2====6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为8Li+3SOCl2====6LiCl+Li2SO3+2S,下列叙述中正确的是( )A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1
溶解在亚硫酰氯(![]() )中形成的,电池总反应方程式为:8Li+3SOCl2====6LiCl+
)中形成的,电池总反应方程式为:8Li+3SOCl2====6LiCl+
Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入碱溶液,对电池反应无影响
B.电池的正极为:Li-e-====Li+
C.电池工作过程中,亚硫酰氯(SOCl2)仅被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A
B
D
C
C
B
C
D
D
C
C
B
B
A
D
16.每空2分,共8分。
(1)2ClO3-+SO2 ===2ClO2+SO42-;(2)D;(3)4.816a×1023;(4)8┱1。
17.共10分。
⑴D(1分);⑵Cu(1分);H2(1分);⑶①随着反应进行生成铝离子浓度增大,水解产生的H+的浓度增大,②该反应放热,升高温度反应加快,③铜与铝构成原电池,加快铝溶解;(3分)⑷A、B、D;(2分,少选、错选均不给分)⑸A(1分),电解质性质(1分)(其它合理解答同样给分)。
 18.共10分。
18.共10分。
⑴Na (1分) ;⑵ Cl―<S2―(1分)
⑶极性共价键(1分),非极性分子(1分);NH3(1分);c、d (1分,少选、错选均不给分) ;⑷H2S+Cl2=2HCl+S↓(2分);⑸Cl2(1分), 原子晶体(1分)。
19.每个方程式2分,其它每空1分,共8分。
⑴ade(1分,少选、错选均不给分);⑵FeCl3(1分);防止氯化亚铁被氧化(1分);Fe3++3SCN-=Fe(SCN)3(2分,合理反应都可以给分);⑶Al(OH)3(1分);Al3++3AlO2-+6H2O=4Al(OH)3↓(2分)。
20.每空1分,共11分。
【方法一】⑴分液漏斗;浓硫酸;防止外界水蒸气进入;⑵87.4% ;SO2不能完全被吸收 ,装置中有SO2滞留。
【方法二】2Na2SO3+O2=2Na2SO4
;[(
【方法三】(1)不能;酸性条件下Ba(NO3)2将SO2氧化成BaSO4;(2) 向漏斗内加水至刚好浸没沉淀,待水自然流出后再加水洗涤2~3次。
21.每空2分,共8分。
⑴3Cu2O+14H+ +2NO3- =6Cu2+ +2NO↑+7H2O;⑵32g;⑶0.2mol;⑷0.1<n<0.3。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com