
题目列表(包括答案和解析)
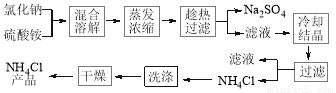
氯化铵简称“氯铵”,又称卤砂,为无色晶体或白色结晶性粉末,易溶于水中,在工农业生产中用途广泛。以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
氯化铵和硫酸钠的溶解度随温度变化如图所示。回答下列问题:
(1)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(2)实验过程中趁热过滤的目的是 。
(3)写出“蒸发浓缩”时发生的化学方程式: 。
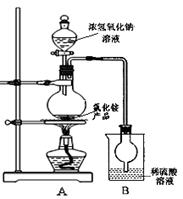
(4)某研究性学习小组为测定该NH4Cl产品中氮的含量,设计了如图装置,并进行了讨论。
甲同学:根据此实验测得的数据,计算的NH4Cl产品的含氮量可能偏高,因为实验装置中存在一个明显缺陷是: ____ 。
乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液的离子反应方程式为 ,反应过程中NaOH一定要足量并充分加热,原因是 。
用改进后的实验装置重新进行实验,称取13.0gNH4Cl产品,测得实验后B装置增重3.4g。则该化肥含氮量为 。
氯化铵简称“氯铵”,又称卤砂,为无色晶体或白色结晶性粉末,易溶于水中,在工农业生产中用途广泛。以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
氯化铵和硫酸钠的溶解度随温度变化如图所示。回答下列问题:

(1)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(2)实验过程中趁热过滤的目的是 。
(3)写出“蒸发浓缩”时发生的化学方程式: 。
(4)某研究性学习小组为测定该NH4Cl产品中氮的含量,设计了如图装置,并进行了讨论。
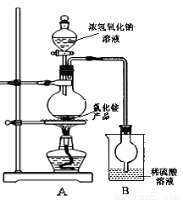
甲同学:根据此实验测得的数据,计算的NH4Cl产品的含氮量可能偏高,因为实验装置中存在一个明显缺陷是: ____ 。
乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液的离子反应方程式为 ,反应过程中NaOH一定要足量并充分加热,原因是 。
用改进后的实验装置重新进行实验,称取13.0gNH4Cl产品,测得实验后B装置增重3.4g。则该化肥含氮量为 。

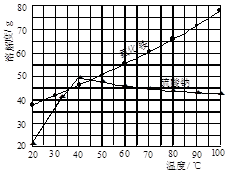
磷化氢(![]() )是无色剧毒气体(沸点-89.7℃,其中含微量
)是无色剧毒气体(沸点-89.7℃,其中含微量![]() 而易自燃.其制取原理类似于实验室制氨气,现用下图装置制取
而易自燃.其制取原理类似于实验室制氨气,现用下图装置制取![]() 并验证其性质.请回答:
并验证其性质.请回答:

(1)用碘化磷(![]() )和烧碱反应制取
)和烧碱反应制取![]() 的化学方程式________.
的化学方程式________.
(2)实验开始时,先从分液漏斗中往盛有碘化磷的烧瓶A中加入过量乙醚(无色液体,沸点34.5℃,微溶于水,不与![]() 反应),微热数分钟后再从分液漏斗中向烧瓶里加入一定量的浓NaOH溶液继续加热.在B处用电热器控制温度在300℃左右,实验过程中可观察到:
反应),微热数分钟后再从分液漏斗中向烧瓶里加入一定量的浓NaOH溶液继续加热.在B处用电热器控制温度在300℃左右,实验过程中可观察到:
①用水冷却的C中有白色蜡状固体生成.
②D试管中![]() 溶液的颜色由棕黄色变成淡绿色,同时也有白色蜡状物生成.
溶液的颜色由棕黄色变成淡绿色,同时也有白色蜡状物生成.
③E处点燃尾气,呈淡蓝色火焰.则:
C中的白色蜡状固体是(填分子式)________,能说明![]() 具有________性质.试管D中反应的化学方程式是________,说明
具有________性质.试管D中反应的化学方程式是________,说明![]() 具有________性.
具有________性.
(3)实验时E处尾气须点燃,原因是________.
(4)实验开始时,先向烧瓶中加入乙醚并微热,其目的是________.
(5)D中液面上有少量乙醚层,出现的原因是________
某化学小组以苯甲酸为原料制取苯甲酸甲酯。有关物质的沸点和相对分子质量如表:
I.合成苯甲酸甲酯粗产品
在烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约0.79g/mL) ,再小心加入3mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)该反应中浓硫酸的作用 ,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式 ,甲醇过量的原因 。
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是 。
(3)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的特点,最好采用 装置(填“甲”、“乙”、“丙”)。
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为 ,操作II为 。
(5)以上流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是 。
(6)苯甲酸甲酯的产率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com