
题目列表(包括答案和解析)
(1)为测定某地空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定_________________。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助同学完成100 mL 5×10-4 mol·L-1碘溶液的配制:
第一步:准确称取1.27 g碘单质加入烧杯中,________________;
第二步:______________________________________________________________;
第三步:从第二步所得溶液中,取出10.00 mL溶液于100 mL容量瓶中,加水稀释至刻度线。

(2)乙同学拟用下列简易装置测定空气中的SO2含量:准确移取50 mL 5×10-4mol·L-1的碘溶液,注入上图所示广口瓶中,加2—3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100 mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,抽气次数至少为_____次,方可说明该地空气中排放的SO2含量符合标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:
_____________________________________________________________________。
③丙同学认为:乙同学的实验方案抽气次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:_______________________________________。
(3)改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用______________(选填a.浓硫酸 b.银氨溶液 c.新制的氢氧化铜 d.酸化的高锰酸钾溶液)。
“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验。因其具有许多优点,已被广泛应用于化学实验中。下列三个实验均为“套管实验”,请观察、分析, 回答下列问题:
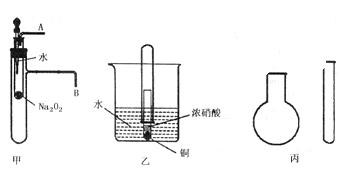
实验一:图甲是对课本有关Na2O2某性质的两个实验的改进。
⑴将胶头滴管中的水滴入小试管,然后,在导管口A、B处分别进行适当操作,再根据所观察现象可得到的两个结论是_________________,______________________。
⑵写出甲中反应的离子方程式_________________________________________。
实验二:图乙是对铜和浓硝酸反应实验的改进。
⑶写出铜和浓硝酸反应的离子方程式为_________________________________。
⑷反应开始后,能观察到的现象是__________________________________,随后气体颜色逐渐变浅;大试管中液面上升。
⑸与普通演示实验相比,此实验除操作方便之外,还有_____________等优点。
实验三、现有下列药品:A.氯化铵固体,B.氢氧化钠固体,C.浓氨水,D.浓硫酸,E.碳酸氢铵。采用“套管法”,只用一支试管(药匙等辅助用品略,不加热),选择合适的药品就可在圆底烧瓶中集满喷泉实验用的氨气(如图丙)。
⑹此实验制备氨气选用的最合适药品是__________(填序号)。
(8分)“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验。因其具有许多优点,已被广泛应用于化学实验中。下列三个实验均为“套管实验”,请观察、分析,回答下列问题:
实验一:图甲是对课本有关Na2O2某性质的两个实验的改进。
⑴将胶头滴管中的水滴入小试管,然后,在导管口A、B处分别进行适当操作,再根据所观察现象可得到的两个结论是___________________,_________________。
⑵写出甲中反应的离子方程式_________________________________。
实验二:图乙是对铜和浓硝酸反应实验的改进。
⑶写出铜和浓硝酸反应的离子方程式为_________________________________。
⑷反应开始后,能观察到的现象是__________________________________,随后气体颜色逐渐变浅;大试管中液面上升。
⑸与普通演示实验相比,此实验除操作方便之外,还有_____________等优点。
实验三、现有下列药品:A.氯化铵固体,B.氢氧化钠固体,C.浓氨水,D.浓硫酸,E.碳酸氢铵。采用“套管法”,只用一支试管(药匙等辅助用品略,不加热),选择合适的药品就可在圆底烧瓶中集满喷泉实验用的氨气(如图丙)。
⑹此实验制备氨气选用的最合适药品是__________(填序号)。
“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验。因其具有许多优点,已被广泛应用于化学实验中。下列三个实验均为“套管实验”,请观察、分析,回答下列问题:
实验一:图甲是对课本有关Na2O2某性质的两个实验的改进。
⑴将胶头滴管中的水滴入小试管,然后,在导管口A、B处分别进行适当操作,再根据所观察现象可得到的两个结论是_________________,______________________。
⑵写出甲中反应的离子方程式_________________________________________。
实验二:图乙是对铜和浓硝酸反应实验的改进。
⑶写出铜和浓硝酸反应的离子方程式为_________________________________。
⑷反应开始后,能观察到的现象是__________________________________,随后气体颜色逐渐变浅;大试管中液面上升。
⑸与普通演示实验相比,此实验除操作方便之外,还有_____________等优点。
实验三、现有下列药品:A.氯化铵固体,B.氢氧化钠固体,C.浓氨水,D.浓硫酸,E.碳酸氢铵。采用“套管法”,只用一支试管(药匙等辅助用品略,不加热),选择合适的药品就可在圆底烧瓶中集满喷泉实验用的氨气(如图丙)。
⑹此实验制备氨气选用的最合适药品是__________(填序号)。
(8分)“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验。因其具有许多优点,已被广泛应用于化学实验中。下列三个实验均为“套管实验”,请观察、分析,回答下列问题:
实验一:图甲是对课本有关Na2O2某性质的两个实验的改进。
⑴将胶头滴管中的水滴入小试管,然后,在导管口A、B处分别进行适当操作,再根据所观察现象可得到的两个结论是___________________,_________________。
⑵写出甲中反应的离子方程式_________________________________。
实验二:图乙是对铜和浓硝酸反应实验的改进。
⑶写出铜和浓硝酸反应的离子方程式为_________________________________。
⑷反应开始后,能观察到的现象是__________________________________,随后气体颜色逐渐变浅;大试管中液面上升。
⑸与普通演示实验相比,此实验除操作方便之外,还有_____________等优点。
实验三、现有下列药品:A.氯化铵固体,B.氢 氧化钠固体,C.浓氨水,D.浓硫酸,E.碳酸氢铵。采用“套管法”,只用一支试管(药匙等辅助用品略,不加热),选择合适的药品就可在圆底烧瓶中集满喷泉实验用的氨气(如图丙)。
氧化钠固体,C.浓氨水,D.浓硫酸,E.碳酸氢铵。采用“套管法”,只用一支试管(药匙等辅助用品略,不加热),选择合适的药品就可在圆底烧瓶中集满喷泉实验用的氨气(如图丙)。
⑹此实验制备氨气选用的最合适药品是__________(填序号)。
一、选择题 :每小题2分,共50分。
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
B
C
B
A
C
B
C
D
A
B
C
D
A
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
D
A
C
B
B
A
D
D
B
A
B
A
一、填空题(共28分)
 26.(1) ∶N∶∶N∶(1分);氮气分子内的氮氮三键很牢固,故氮分子在通常情况下很稳定(2分)
26.(1) ∶N∶∶N∶(1分);氮气分子内的氮氮三键很牢固,故氮分子在通常情况下很稳定(2分)
(2)Mg3N2+8H2O===3Mg(OH)2↓+2NH3?H2O(2分)。
27.(1)②⑥; (2)①④; (3)③⑤。……………………………(每空1分,共3分)
28.(1)2、16 === 2、2、5、8 (2分);(2)5:3(或10:6) (1分);(3)2 (1分)。
29.(1)1,50? ;(2)C; (3) 1 。……………………………… (每空1分,共4分)
30.Cu2++2e―===Cu; 6.5 。…………………………………………… (每空2分,共4分)
|