
题目列表(包括答案和解析)
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)![]() FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
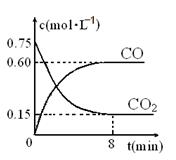
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g) + O2(g) == 2CO2(g);△H=-566 kJ·mol-1
2H2(g) + O2(g) == 2H2O(g);△H=-483.6 kJ·mol-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
。
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g) + O2(g)== 2CO2(g);△H=-566kJ·mol-1
2H2(g) + O2(g) == 2H2O(g);△H=-483.6kJ·mol-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
。
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
| A.升高温度 | B.增大压强 | C.充入一定量氮气 | D.再加入一些铁粉 |
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0

(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g) + O2(g) == 2CO2(g);△H=-566 kJ·mol-1
2H2(g) + O2(g) == 2H2O(g);△H=-483.6 kJ·mol-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
。
一定浓度NaHCO3溶液与CuSO4溶液反应后生成了蓝绿色颗粒状沉淀。就沉淀成分提出了如下三种假设:
假设一:沉淀是CuCO3;假设二:沉淀是Cu(OH)2;
假设三:沉淀是CuCO3和Cu(OH)2的混合物。
(1)写出假设二,沉淀是Cu(OH)2生成的理由 (用离子方程式表示);
(2)为了探究沉淀的成分,取出了一部分沉淀,滴加稀盐酸,有气体放出。凭此现象,判断沉淀中含有 _;
(3)为了进一步探究沉淀的成分,进而确定假设中何种假设成立,设计实验,装置图如下: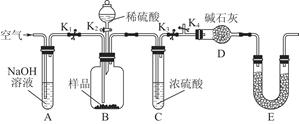
①研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 _ 、洗涤、干燥;
②装置E中药品的名称是 __作用为 __;
③实验过程中有以下操作步骤:a.打开K1、K3,关闭K2、K4,通入过量空气。此步骤的作用是 ;
b.关闭K1、K3,打开K2、K4,充分反应,c.再通入过量空气时,活塞处于打开的是 _,关闭的是 _。
④若沉淀样品的质量为m g,装置D的质量增加了n g;若沉淀样品为纯净物,m、 n之间的关系为 _
若假设三成立,则Cu(OH)2的质量分数为 _;若不进行步骤c,则会使测得结果 (填“偏高”“无影响”“偏低”)。
物理答案
14.D 15.AC 16.AD 17.A 18.C 19.A 20.D 21.ABC
22. 3 , 1350
23.(1)
(2)S=
24.解:(1)s=
(2) F=0.3N 方向竖直向下
25.(1) 0.8s (2)
化学答案
选择题:
题号
6
7
8
9
10
11
12
13
答案
A
C
D
C
B
D
B
D
26、(共16分)(1)CO32― + H2O HCO3―
+ OH― ;C(Na+)+C(H+)=
HCO3―
+ OH― ;C(Na+)+C(H+)=
(2)8.0×10-9
(3)CO32-和HCO3-(1分); 1 :1(1分)
(4)先增大后又减小。CO32-+H+=HCO3-(2分);HCO3-+H+=CO2↑+H2O(2分)或HCO3-+H+= H2CO3
(5)6 (除标明分值之外,其余每空各2分。)
(27)、(17分)玻璃棒(1分);除掉氯化钠晶体中的水。
(2)硝酸银不稳定,见光易分解,放置之后的硝酸银溶液的浓度会发生变化,对滴定结果造成影响。
(3)B(1分) (4) (5)c (
(5)c ( )在
)在 mol?L-1这样小的浓度附近时,黄色很浅。
mol?L-1这样小的浓度附近时,黄色很浅。
(6)0.095,1.775. (7)蒸馏水 (1分);自来水中含有氯离子,容易生成氯化银沉淀附于管壁上,不宜洗涤。(除标明分值之外,其余每空各2分。)
(28)、(12分)(1)
29、(15分)Ⅰ (1)环形玻璃搅拌棒(不答环形不得分)、量筒
(2)
Ⅱ(1)(N2H4(1)+O2(g)===N2(g)+2H2O(l) △H= -624.0kJ/mol
(2) O2 +4e-+2H2O == 4OH- N2H4+4OH--4e-=4H2O+N2↑
(3)① Cu2++2 e-== Cu ②112
(4)ClO-+2NH3=N2H4+Cl-+H2O
生物答案:
C B D D B 30 (1)左侧 ⑵a|、b、c、d ⑶200 120 (4)实验步骤:
②A组幼苗放在有光照的环境中,B组幼苗放在无光的黑暗环境中;
③置于其它条件相同且适宜的环境中培养一段时间,观察幼苗的颜色。
实验结果及相关结论:
①A变绿B不变,说明光是叶绿素合成的必备条件;
②A不变B变绿,说明叶绿素合成需要在无光条件下进行;
③A和B均变绿,说明叶绿素的合成与光照无关
31 (1)不需要 耐高温 (2)引物对B
(3) 或
或 或
或
(4)没有 (5)脓杆菌 (6) 2 1 (7)B 浆 记忆
天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
| ||||||||||||||||||||||||||||||||||