
题目列表(包括答案和解析)
已知:![]() ;
;![]() ,下列说法正确的是
,下列说法正确的是
A.![]()
![]() 气体分解成
气体分解成![]() 的
的![]() 和
和![]() 的
的![]() 吸收
吸收![]() 热量
热量
B.![]()
![]() 与
与![]()
![]() 反应生成
反应生成![]() 液态
液态![]() 放出的热量小于
放出的热量小于![]()
C.在相同条件下,![]()
![]() 与
与![]()
![]() 的能量总和大于
的能量总和大于![]()
![]() 气体的能量
气体的能量
D.1个![]() 分子与1个
分子与1个![]() 分子反应生成2个
分子反应生成2个![]() 分子放出
分子放出![]()
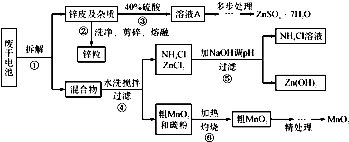
| NH3?H2O的Kb | Zn 2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
| ||
| ||
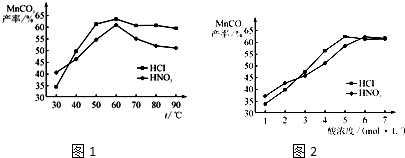
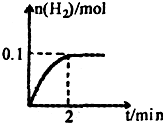
| A.H2与F2反应的热化学方程式为: H2(g)+F2(g)=2HF(g) ΔH=-541 kJ |
| B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 |
| C.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ |
| D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
一、选择题(本题包括21小题,每小题2分,共42分。)
1.D 2.C 3.C 4.D 5.C 6.C 7.D 8 .D 9.C 10.C
11.B 12.C 13.C 14.C 15.D 16.C 17.B 18.D 19.B 20.A二、本题包括1小题,共12分。
21.(12分)
(1)B中装无水硫酸铜,检验水蒸气;C中装澄清的石灰水,检验二氧化碳;(每空1分)
(2)验纯后点燃E处的气体,火焰呈蓝色。(2分,不答“验纯”扣1分)
(3)点燃前应验纯;CO有毒,实验要通风;加热时要均匀受热等。(2分)
(4)挥发出来的草酸蒸气与石灰水反应生成了草酸钙沉淀,会干扰 的检验(2分)
的检验(2分)
在装置B和C装置间增加―个装有水(或烧碱溶液)的洗气装置(2分)
三、本题包括3小题,共38分。
22.(每空2分,共12分)
(1)
 (2) >
(2) >
(3)
(4) (5) 336
(5) 336
23.(每空2分,共12分)
(1)A:Si B:Mg (2)抑制氯化镁水解
(3) ①
③
④
24.(每空2分,共14分)
(1) (2)
(2)
(3) 负极反应产物
负极反应产物
(4)①
②
③
四、本题包括1小题,共10分。
25.(1) (2分)
(2分)
 (2分)
(2分)
(2)解:设生成 的物质的量为
的物质的量为 。由上述方程式知:
。由上述方程式知:






生成 的质量为:
的质量为: (2分)
(2分)
(3)①5、1、8、1、5、4 (2分) ②83.33% (2分)
(2分) ②83.33% (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com