
题目列表(包括答案和解析)
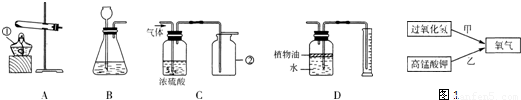
下图所示为实验室常用的实验装置。

据此回答下列问题:
⑴写出带标号仪器的名称:① ② ;
⑵实验室通常用稀盐酸和石灰石反应制取CO2,该反应的化学方程式为 ,发生装置为 ;装置F可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是 ,植物油上方原有的空气对实验的结果 (填“有”或“没有”)明显影响。
⑶小丫在探究CO2与NaOH溶液反应的实验中,先用铝制易拉罐收集满一罐CO2气体,然后迅速向其中加入一定量的NaOH浓溶液,立即将易拉罐口封闭(不漏气),轻轻摇动易拉罐,发现易拉罐很快变瘪,但过一段时间后,易拉罐又重新鼓起来(反应过程中温度的变化忽略不计)。
【讨论】小丫认为易拉罐变瘪,说明CO2与NaOH溶液发生反应;小敏认为此结论不合理,还需进一步验证,验证方法是 ;易拉罐为什么又后鼓起来?是不是反应又产生了气体,该气体的成分?
【提出猜想】a.可能是CO2 b.可能是 。
【查阅资料】①Na2CO3具有较强的热稳定性,只有在高温条件下才会分解;
②铝不仅与酸反应,还能与碱溶液反应2Al+2NaOH+2H2O==2NaAlO2+3X↑
【实验验证】
①将易拉罐口打开,迅速用燃着的木条伸入罐口,发出“噗”的一声,产生淡蓝色火焰,片刻后熄灭。证明猜想 成立;
②取少量铝片于试管中,先加入适量的水,无明显变化。片刻后再加入少量的氢氧化钠浓溶液,产生气泡。该步实验的目的是 ;
【结论】CO2与NaOH反应的化学方程式是 ;
【反思与应用】在生活中铝制容器不能用来盛装酸性物质,也不能盛装 性物质。
【解析】(1)熟知实验常用仪器的名称(2) (2)实验室通常用稀盐酸和石灰石反应制取CO2,反应原理是:CaCO3+2HCl=CaCl2+CO2↑+H2O,属于“固液不加热型”.二氧化碳气体密度比空气大,易溶于水.据此来选择发生装置和收集装置即可.由于实验测得的气体为F装置内的CO2气体的体积,而空气中也有CO2,又因为CO2既不溶于植物油,也不和植物油反应,所以在水面上放一层植物油的目的是防止CO2溶于水、防止CO2与水反应、防止CO2与水接触;所以植物油上方原有的空气对实验的结果就不会有明显影响.
(3)【讨论】根据碳酸离子与钙离子反应生成沉淀碳酸钙;
【提出猜想】根据质量守恒定律进行猜想,可能是氢气;
【实验验证】①根据燃烧的现象进行分析;
②根据实验内容和过程进行分析;
【结论】根据CO2与NaOH的反应写出反应的方程式;
【反思与应用】根据铝的性质分析铝制容器使用注意的事项.
| ||
| ||
请用化学方程式解释下列现象:
(1)小颖同学在探究二氧化碳性质时,将二氧化碳气体
通入紫色石蕊试液,石蕊试液很快变红色,原因
是______。铁管容易生锈,工业上常用稀盐酸
来除铁锈__ __。
(2)长期存放石灰水的甁壁上有一层薄膜,该薄膜形成的原因是 ,在实验室里常用稀盐酸清洗,发生反应的化学方程式为 。
(3)纯净物A可用作气体燃料。在一定条件下A与B按下图所示充分反应,生成C和D。
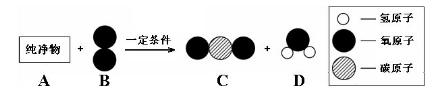
已知A的一个分子中含有3个碳原子,且A的相对分子质量为44,则该反应的化学方程式为 。

2009.1
一、选择题(共35分,每小题1分)
题号
1
2
3
4
5
6
7
8
9
10
答案
B
C
D
C
C
B
C
D
A
C
题号
11
12
13
14
15
16
17
18
19
20
答案
B
B
D
D
D
D
C
D
D
B
题号
21
22
23
24
25
26
27
28
29
30
答案
C
C
C
D
B
D
C
C
D
C
题号
31
32
33
34
35
答案
D
A
C
D
C
二、填空题(共30分,37―40题中的方程式每个2分,其它每空1分)
36.(5分)(1)3N 2Na+ Al2O3
(2)① 2CO + O2 = 2CO2
②在化学反应前后原子的种类、数目不变(或在化学反应前后元素的种类不变;或在化学反应中分子可分,而原子不可分等)
37.(7分)(1)海水 分别取少量放入蒸发皿加热蒸干后,有水痕出现的为矿泉水,否则为蒸馏水。
(2) ①、②、④ (3)不合理,此法只能除去不溶于水的杂质
/2009年北京市通州区第一学期期末考试初三化学.files/image042.gif) (4)用洗菜淘米的水浇花(或用洗衣服的水冲洗马桶等)
(4)用洗菜淘米的水浇花(或用洗衣服的水冲洗马桶等)
(5)2H2O 2H2↑+ O2↑
38.(8分)(1)天然气 (2)风 太阳
/2009年北京市通州区第一学期期末考试初三化学.files/image044.gif) (3)① 2H2 + O2 2H2O ② A、B
(3)① 2H2 + O2 2H2O ② A、B
/2009年北京市通州区第一学期期末考试初三化学.files/image044.gif) (4)CH4 + 2O2 CO2 + 2H2O
(4)CH4 + 2O2 CO2 + 2H2O
39.(6分)(1)变浑浊(或有白色沉淀) Ca(OH)2 + CO2 = CaCO3↓+ H2O
(2)处理尾气防止一氧化碳污染空气(或烧掉一氧化碳等)
/2009年北京市通州区第一学期期末考试初三化学.files/image047.gif) (3)Fe2O3 + 3CO 2Fe + 3CO2
(3)Fe2O3 + 3CO 2Fe + 3CO2
40.(9分)(1)CaCO3
(2)CaO + H2O = Ca(OH)2 化合反应
三、实验题(共25分,方程式每个2分。其它每空1分)
41.(7分)(1)①量筒(或④) ②试管(或①)
③试管、烧杯、烧瓶、酒精灯、铁架台(或①、②、③、⑥、⑦)
(2)①一定的温度(或达到着火点) ②它们的着火点不同
都是可燃物质、都露置在空气中、都在相同温度下
(3)B、D(或B、A)
/2009年北京市通州区第一学期期末考试初三化学.files/image049.gif) 42.(10分)(1)A、B C、E
42.(10分)(1)A、B C、E
B、C或E 2H2O2 2H2O + O2↑
(2)CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ B、C
将燃着的木条放到集气瓶口,若火焰立即熄灭为满,否则不满。
(3)反应物的状态、反应所需的条件和生成气体的性质
43.(8分)(1)Fe + 2HCl = FeCl2 + H2↑
(2)铜片上有银白色物质析出,铜的活泼性大于银
(3)锌产生气体比盐酸的快
(4)乙:Fe CuSO4[或CuCl2、Cu(NO3)2] 丙:Cu HCl
四、计算题(共10分,除已注明的外,其它每空1分)
44.(5分)(1)① 20 ② 18∶3∶8(或72∶12∶32)
③ /2009年北京市通州区第一学期期末考试初三化学.files/image051.gif)
(2)① 分解反应 ② 111∶22∶9∶80
45.(5分)(1)碳粉(或碳) …………(1分)
(2)解:设生铁样品中含有铁的质量分数为x%
Fe + H2SO4 = FeSO4 + H2↑ …………(1分)
|