
题目列表(包括答案和解析)
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A. 某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+) >c(OH-)>c(H+)( )
B. 在NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C. 将相同物质的量浓度的某弱酸(A-为弱酸根)溶液与KA溶液等体积混匀,测得混合后溶液pH=10,则混合液中c(K+)>c(A-)
D. 0.1 mol·L-1 CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
下列有关溶液中的离子反应及离子浓度大小表述正确的是
A.中和相同体积、相同pH的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
B.在NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.在NaOH溶液中加入与其等物质的量的CH3COOH的过程中,始终有
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.将相同物质的量浓度的某弱酸(A-为弱酸根)溶液与KA溶液等体积混匀,测得混合后溶液pH=10,则混合液中c(K+)>c(A-)
下列有关溶液中的离子反应及离子浓度大小表述正确的是
A.中和相同体积、相同pH的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
B.在NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.在NaOH溶液中加入与其等物质的量的CH3COOH的过程中,始终有
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.将相同物质的量浓度的某弱酸(A-为弱酸根)溶液与KA溶液等体积混匀,测得混合后溶液pH=10,则混合液中c(K+)>c(A-)
下列表述中正确的是 ( )
A、NH4C1溶液因水解而显酸性,故NH4C1是弱电解质
B、纯碱溶液因水解而显碱性,水解的离子方程式为:CO32—+H2O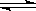 H2CO3+2OH—
H2CO3+2OH—
C、可乐因含碳酸而显酸性,电离方程式为:H2CO3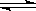 CO32—+2H+
CO32—+2H+
D、配制FeC13 溶液时,先将FeC13 溶于较浓的盐酸中,然后再加水稀释到所需浓度
【解析】溶于水或在熔融状态下部分电离的是弱电解质,全部电离的是强电解质,与物质是否水解无关,A不正确。多元弱酸根水解是分步进行的,B不正确。同样多元弱酸的电离也是分步电离的,所以C也不正确。铁离子水解显酸性,先溶解在浓盐酸中可以抑制铁离子的水解,D正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com