
题目列表(包括答案和解析)
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4?FeSO4?6H2O | 17.2 | 26.4 | 33.0 | 46.0 | — | — |

(11分)硫酸亚铁铵的化学式为(NH4)2SO4•FeSO4•6H2O,商品名为莫尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了。三种盐的溶解度(单位为g/100g水)如下表:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
(NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
(NH4)2SO4•FeSO4•6H2O | 17.2 | 26.4 | 33.0 | 46.0 | ― | ― |
(一)实验室制取少量莫尔盐的流程如下:
 |
试回答下列问题:
(1)步骤1中加入10%Na2CO3溶液的主要作用是除去铁屑表面的油污,简述其除去油污的原理
(2)将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机
(3)步骤4中析出的晶体不含(NH4)2SO4和FeSO4的原因是 ,理论上制得的莫尔盐的质量为 。
(二)称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液。用未知浓度的KMnO4酸性溶液进行滴定。
(1)滴定时,将KMnO4酸性溶液装在_______(填“酸式”或“碱式”)滴定管。试写出该滴定过程中的离子方程式:_ ___ __;
(2)判断该反应到达滴定终点的现象为 ;
(3)假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为 mol/L
硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6H2O,商品名为莫尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了。三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4??FeSO4??6H2O | 17.2 | 26.4 | 33.0 | 46.0 | — | — |
实验室制取少量莫尔盐的流程如下:

试回答下列问题:
(1)步骤1中加入10%Na2CO3溶液的主要作用是除去铁屑表面的油污,简述其除去油污的原理
(2)将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机
(3)步骤4中析出的晶体不含(NH4)2SO4和FeSO4的原因是 ,理论上制得的莫尔盐的质量为 。
(二)称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液。用未知浓度的KMnO4酸性溶液进行滴定。
(1)滴定时,将KMnO4酸性溶液装在_______(填“酸式”或“碱式”)滴定管。试写出该滴定过程中的离子方程式:___ __;
(2)判断该反应到达滴定终点的现象为 ;
(3)假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为 mol/L
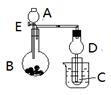
Ⅰ.溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
| | 苯 | 溴 | 溴苯 |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |


| | 苯 | 溴 | 溴苯 |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
答案
B
C
A
C
D
B
C
A
A
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确得2分,但只要选错一个就得0分)
题号
10
11
12
13
14
15
16
17
18
答案
BC
A
D
BD
AC
AC
C
C
BD
三、(本题包括3小题,共34分)
19.(一)(6分)
(1)热的Na2CO3会发生水解反应使溶液碱性,在碱性条件下使油脂充分水解而除去(2分)
(2) 浓缩至液体表面出现洁净薄膜(1分)
(3) 在相同温度下,(NH4)2SO4•FeSO4•6H2O的溶解度比(NH4)2SO4、FeSO4小(1分) ;
7(m1―m2)g (1分)
(二).(共5分)
(1)酸式(1分) 5Fe2+ + MnO4- + 8H+= 5Fe3++ Mn2+ + 4H2O(2分)
(2)当最后一滴KMnO4酸性溶液滴下时,溶液变成紫色,30s内不褪色,说明达到滴定终点(1分)
(3)1/V(1分)
20.(10分)
[交流与讨论](1)2AI+2NaOH+2H20=2NaAl02+3H2 ↑ (2分)
(2)97mL (2分)
(3)滤纸破损;过滤时漏斗里的液面高于滤纸边缘;仪器不干净等(1分)
(4)偏高 (1分)
[实验拓展](4分) 
21、(13分)
(1)①产生二氧化硫没有干燥,水蒸气会与Na2O2反应;②在B、C之间加一个装有NaOH溶液的洗气瓶 除去SO2气体(每空1分,共3分)
(2) 2Na2O2+2CO2=2Na2CO3+O2↑(2分)
①提出合理假设
假设1:白色固体为Na2SO3 假设2:白色固体为Na2SO3与Na2SO4 的混合物
假设3:白色固体为Na2SO4(每空1分,共3分)
② (每空1分,共5分)
实验操作
预期现象与结论
步骤1:取少量白色固体于试管,加入足量的稀盐酸
若闻到刺激性气味,说明白色固体含有Na2SO3.
步骤2:在步骤1的溶液加入足量的氯化钡溶液
若有白色沉淀生成,则说明白色固体含Na2SO4.
若步骤1现象明显,而步骤2没明显现象,则说明白色固体为Na2SO3;若步骤1现象不明显,步骤2现象明显,则说明白色固体为Na2SO4;若上述两个实验现象均有,则说明白色固体既含有Na2SO3,又含有Na2SO4。
四、(本题包括3小题,共34分)
22.(12分)
(1)硅(2分)(2)原子 ,C3N4 ,高温、高压 (各2分,共6分)
(3)4Al + 3O2 = 2Al2O3 IIA(各2分,共4分)
23(14分)
(1)CuO+2H+→Cu2++H2O(2分)
(2)烧杯、量筒(4分,各2分)
(3)SO2(2分)
(4)取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有(2分)
(5)铜粉的质量(2分) 最终所得CuO的质量(2分)。
24 (8分)
(1)NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ?mol-1(2分)
(2)①>(2分) ②C(2分)
(3)①N2H62++H2O [N2H5?H2O]++H+(2分)
[N2H5?H2O]++H+(2分)
五、(本题包括1小题,9分)
25(9分)
(1)C6H6(1分)
(2)碳碳双键 酯基 (每个1分,共2分)
(3)分别取少量粗品和纯品于试管,分别加入NaHCO3溶液,若试管中有气泡产生,则原试剂为粗品。(其它合理答案也给分)(2分)
 |
(4) (2分)
(5) ;
; (每个1分,共2分)
(每个1分,共2分)
六、选做题(本题包括2小题,每小题10分,考生只能选做一题)
26.(10分)
⑴加成反应 消去反应 取代反应 (3分)
⑵ +2NaOH→
+2NaOH→ +2NaBr (2分)
+2NaBr (2分)
⑶ ③; 保护A分子中C=C不被氧化
 (5分)
(5分)
27.(10分)
(1)1s22s22p63s23p6 (1分)
(2)ZCl<Ycl<XCl (1分)
(3) Cu 4 (每空2分,共4分)
(4) CH3―CH2―Cl中与Cl原子成键的C以sp3杂化,而CH2=CH2―Cl中与Cl原子成键的C以sp2杂化,电子云密度不同;CH3―CH2―Cl中的C―Cl的键长比CH2=CH2―Cl中C―Cl要长;CH2=CH2―Cl的∏键对Cl的作用力比CH3―CH2―Cl的a键强。
(答对两点给2分)
(5)HF沸点比HCl高;氢氟酸是弱酸,盐酸是强酸;实验测得HF分子质量偏大。
(答对两点给2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com