
题目列表(包括答案和解析)
已知某气态烃1mol最多可与2molHCl发生加成反应,所得产物与Cl2发生取代反应时,若将氢原子全部取代,需要8mol Cl2,则该烃可能是( )
A.丙炔 B.乙炔 C.2-丁炔 D.2-丁烯
【解析】1mol气态烃最多可与2molHCl发生加成反应,说明该气态烃分子中含有碳碳三键或2个碳碳双键。烃在发生取代反应时,1个氢原子就需要1个氯气分子,这说明和2molHCl加成之后,分子内共有8个氢原子,所以原分子中含有6个氢原子,因此其分子式为C4H6,所以正确的答案是C。
已知某气态烃1mol最多可与2molHCl发生加成反应,所得产物与Cl2发生取代反应时,若将氢原子全部取代,需要8mol Cl2,则该烃可能是( )
A.丙炔 B.乙炔 C.2-丁炔 D.2-丁烯
【解析】1mol气态烃最多可与2molHCl发生加成反应,说明该气态烃分子中含有碳碳三键或2个碳碳双键。烃在发生取代反应时,1个氢原子就需要1个氯气分子,这说明和2molHCl加成之后,分子内共有8个氢原子,所以原分子中含有6个氢原子,因此其分子式为C4H6,所以正确的答案是C。
(6分)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为硫酸,其正极反应为_____________ _,若反应过程中转移了2mol电子,可产生水的质量为 g。
(2)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,.其中c(Na+)= 3 c(Cu2+ )= 0.3 mol/L,取该混合液100 mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112 L(已折算到标准状况)气体。此时氢氧燃料电池外电路中转移电子的物质的量为 mol。(不考虑电路中的其它损耗)。
【解析】(1)在燃料电池中正极通入的是氧气,所以正极反应式为O2 + 4H+ + 4e- = 2H2O。因为总反应是O2 + 2H2 = 2H2O,反应中转移的电子是4mol,所以若反应过程中转移了2mol电子,可产生水的质量为18g。
(2)在阴极上首先是铜离子放电,析出铜,然后是氢离子放电,生成氢气。铜离子是0.1mol/L×0.1L=0.01mol,得到的电子是0.02mol。氢气是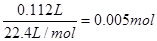 ,转移的电子是0.01mol,所以转移的总的电子是0.03mol。
,转移的电子是0.01mol,所以转移的总的电子是0.03mol。
(6分)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为硫酸,其正极反应为_____________ _,若反应过程中转移了2mol电子,可产生水的质量为 g。
(2)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,.其中c(Na+)= 3 c(Cu2+ )= 0.3 mol/L,取该混合液100 mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112 L(已折算到标准状况)气体。此时氢氧燃料电池外电路中转移电子的物质的量为 mol。(不考虑电路中的其它损耗)。
【解析】(1)在燃料电池中正极通入的是氧气,所以正极反应式为O2 + 4H+ + 4e-= 2H2O。因为总反应是O2 + 2H2 = 2H2O,反应中转移的电子是4mol,所以若反应过程中转移了2mol电子,可产生水的质量为18g。
(2)在阴极上首先是铜离子放电,析出铜,然后是氢离子放电,生成氢气。铜离子是0.1mol/L×0.1L=0.01mol,得到的电子是0.02mol。氢气是![]() ,转移的电子是0.01mol,所以转移的总的电子是0.03mol。
,转移的电子是0.01mol,所以转移的总的电子是0.03mol。
25℃ 时,向1 mL pH=1的硫酸中滴加的10 mL pH= b的NaOH溶液,形成的混合溶液成碱性则b可能为 ( )
A、10 B 、11 C、12 D、13
【解析】混合后溶液显碱性,说明氢氧化钠是过量的,即0.001L×0.1mol/L<0.01L×10(b-14),解得b>12,所以只有选项D是正确的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com