
题目列表(包括答案和解析)
2- 3 |
2- 4 |

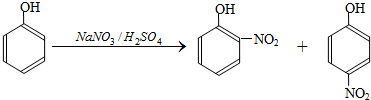
| 密度 (g?mL-1) |
熔点 (℃) |
沸点 (℃) |
溶解性 | 其他 | |
| 邻硝基苯酚 | 1.495 | 44.45 | 214 | 微溶于冷水,易溶于热水 | 能与水蒸气一同挥发 |
| 对硝基苯酚 | 11.481 | 113.4 | 279 | 稍溶于水 | 不与水蒸气一同挥发 |
| 元素 | A | B | C | D | |
| 性质或结构信息 | 室温下单质呈气态,原子最外层电子数与D相同. | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体 | E是一种气态氧化物丙,丙相对于空气的密度为3.0,溶解于水可得只含单一溶质的弱酸性溶液,该溶液在光照条件下放置酸性会增强 |
第Ⅰ卷(必做,共88分)
一、选择题(每题4分,共60分)
1.D 解析:综合考查了有关细胞代谢、免疫、遗传以及生命活动调节等内容中的四种重要的物质。一种酶只能催化一种或一类化学反应,一种抗体只能与相应的抗原结合,一种tRNA只能转运一种特定的氨基酸,因此以上三种物质都具有特异性。而胰岛素可以作用于体内的各种细胞,不具有特异性。故答案选D。
2.D 解析:动物通过再生又形成了新的器官,器官的形成是细胞分裂、分化的结果,从遗传的角度讲,细胞分化是基因选择性表达的结果。再生能力的形成是在进化过程中长期自然选择的结果。再生由于只形成了部分器官,没有形成个体,所以不能体现出细胞的全能性。故答案选D。
3.D 解析:白细胞穿过毛细血管壁以及在吞噬过程中能做变形运动,原因是细胞膜具有一定的流动性。此过程属于胞吞,需要消耗ATP。白细胞能吞噬所有病原体,不具有特异性,属非特异性免疫。故答案选D。
4.C 解析:DNA的复制发生在细胞核内(线粒体、叶绿体的基质中也可复制),暗反应发生在叶绿体的基质中,氨基酸的脱水缩合发生在核糖体上,以上各生理过程均不发生在膜上。叶绿体内水的光解,发生在叶绿体类囊体的薄膜上。故答案选C。
5.A 解析:该图表示的是一条mRNA上有多个核糖体依次合成蛋白质的过程,由于每个核糖体供用同一条mRNA,所以合成的蛋白质应是相同的。转录的模板是核糖核酸,核糖核苷酸是构成核糖核酸的基本单位,故B不正确。核仁与核糖体的形成有关,核糖体最终应在细胞核中形成,而且叶绿体中的少量DNA也可转录出mRNA,可见mRNA的形成场所主要在细胞核中,所以D不正确。
6.A 解析:可溶性糖和氨基酸等物质的含量会明显提高,使细胞质的渗透压增加,提高了细胞的吸水能力,但不一定能提高细胞对无机盐的吸收能力。这种能力是在长期的进化过程中形成的对环境的一种适应能力,这种特性是可遗传的。可溶性糖和氨基酸等物质的含量明显提高是淀粉水解酶和蛋白质的水解酶活性增强,从而使淀粉和蛋白质大量水解造成的。因此最合理的解释是A选项。
7.D 解析:种群增长率为零时,种群数量达到环境容纳量(即K值),此时种群数量不在继续增加或减少。故答案选D。
8.B 解析:酵母菌只进行有氧呼吸时,吸收氧气的量等于放出CO2的量;只进行无氧呼吸时,只放出CO2;酵母菌既有有氧呼吸,同时又有无氧呼吸时,O2的吸收量小于的CO2的量。所以,酵母菌既有有氧呼吸,同时又有无氧呼吸时,在装置2中的气压增大,使液滴向左移动;而装置1中由于NaOH溶液会吸收细胞呼吸放出的CO2, 所以装置中的气压回减小,导致液滴向左移动。故答案选B。
9.D 解析:A项中性溶液准确; B项Na着火用沙土覆盖 ;C项负极反应为: Al + 4OH - -3e - =AlO2- +2H2O,故选D。
10.B 解析:A项1mol甲基中含有9NA个电子;C项醋酸为弱酸,不完全电离,离子总数小于2NA; D项转移的电子数为3.01×1023个;故选B。
11.A 解析:B项能用;C项SO2+Cl2+2H2O=H2SO4+2HCl失去漂白作用;D项银镜反应用来检验含醛基的物质;故选A。
12.D 解析:A项为 Al3++3NH3?H2O=Al(OH)3↓+3NH4+ ;
B项为Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- ;
C项醋酸为弱酸,应写化学式;故选D。
13.B 解析: ②不是化学平衡; ⑥平衡的移动应使颜色变浅,颜色变深是体积缩小,浓度变大造成的,故选B。
14.A 解析:A项聚氯乙烯保鲜膜有毒,不适合用来包装熟食;故选A。
15.C 解析:A项 Na2CO3溶液中CO32-水解使c (Na+)与c (CO32-)之比大于2:1;
B项醋酸为弱酸,不完全电离,c (H+)之比小于2:
D项比值为1:2;故选C。
|