
题目列表(包括答案和解析)

| ||
| ||
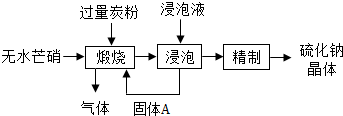 (2012?广陵区二模)硫化钠是重要化工产品.工业上采用无水芒硝(Na2SO4)-炭粉还原法生产硫化钠(Na2S),其流程示意图如图:
(2012?广陵区二模)硫化钠是重要化工产品.工业上采用无水芒硝(Na2SO4)-炭粉还原法生产硫化钠(Na2S),其流程示意图如图:
| ||
| ||
| 142m |
| 233w |
| 142m |
| 233w |
(3分)硫化钠是重要的化工产品。工业上采用无水芒硝(Na2SO4)-炭粉还原法生产硫化钠(Na2S),其流程示意图如下:

(1)上述流程中,获得固体A的操作是 ,固体A的化学式为 。
(2)若“煅烧”所得气体是分子个数比为1∶1的两种碳的氧化物,则“煅烧”时发生的总反应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com