
题目列表(包括答案和解析)
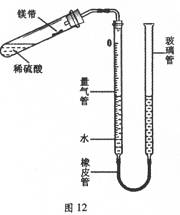
(10分)某课外活动小组同学用图12装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程是:
①取一段镁带样品,准确称得其质量为0.030g。
②往量气管内装水至低于刻度“0”的位置。按图12所示(未装药品)装配好仪器。

③检查装置气密性。
④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞。
⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置。
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应。
⑦待冷却至室温后,再次记录量气管中液面位置。
⑧算出量气管中增加的气体体积为23.96mL。
已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。
请回答下列问题:
(1)写出镁与稀硫酸反应的化学方程式 。
(2)能否用托盘天平称量0.030g镁带样品 。(填“能”或“不能”)
(3)若不改变温度,如何用较简单的方法检查图12所示装置的气密性?
。
(4)经换算,该实验获得的氢气质量为0.0020g。该镁带中单质镁的质量分数是 。
(5)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果 (填“是”或“否”)。理由是 。
(10分)某课外活动小组同学用图12装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程是:
①取一段镁带样品,准确称得其质量为0.030g。
②往量气管内装水至低于刻度“0”的位置。按图12所示(未装药品)装配好仪器。
③检查装置气密性。
④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞。
⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置。
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应。
⑦待冷却至室温后,再次记录量气管中液面位置。
⑧算出量气管中增加的气体体积为23.96mL。
已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。
请回答下列问题:
(1)写出镁与稀硫酸反应的化学方程式 。
(2)能否用托盘天平称量0.030g镁带样品 。(填“能”或“不能”)
(3)若不改变温度,如何用较简单的方法检查图12所示装置的气密性?
。
(4)经换算,该实验获得的氢气质量为0.0020g。该镁带中单质镁的质量分数是 。
(5)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果 (填“是”或“否”)。理由是 。
(10分)某课外活动小组同学用图12装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程是:
①取一段镁带样品,准确称得其质量为0.030g。
②往量气管内装水至低于刻度“0”的位置。按图12所示(未装药品)装配好仪器。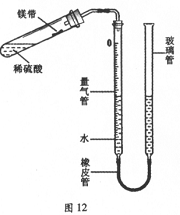
③检查装置气密性。
④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞。
⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置。
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应。
⑦待冷却至室温后,再次记录量气管中液面位置。
⑧算出量气管中增加的气体体积为23.96mL。
已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。
请回答下列问题:
(1)写出镁与稀硫酸反应的化学方程式 。
(2)能否用托盘天平称量0.030g镁带样品 。(填“能”或“不能”)
(3)若不改变温度,如何用较简单的方法检查图12所示装置的气密性?
。
(4)经换算,该实验获得的氢气质量为0.0020g。该镁带中单质镁的质量分数是 。
(5)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果 (填“是”或“否”)。理由是 。
(10佛山25)(9分)气体的实验室制取是初中非常重要的一组实验,结合下列实验装置图回答有关问题:
(1)仪器a的名称是 。
(2)在初中可同时用来制取O2、CO2和H2的发生装置是 (填字母)。
(3)写出实验室用KClO3制氧气的化学方程式 。
(4)用KClO3制氧气需加MnO2作催化剂。若在KClO3中加少量的KMnO4,也能加快KClO3的分解。用文字说明其原因
。
(5)实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸反应来制取SO2。
已知:SO2是一种没有颜色而有刺激性气味的有毒气体,易溶于水,密度比空气大,常温下在空气中不反应。
①制取SO2的化学方程式为_
②制取SO2的收集装置为 (填字母)。
③在收集SO2,为了避免SO2对环境的污染,对SO2的收集装置作了改进(见下图),请你把集气瓶内的导管补充完整(图中“→”表示气体流向)。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com