
题目列表(包括答案和解析)


| ||
| ||

“低碳城市”的理念贯穿在上海世博园的建设中。
(1)“低碳城市”的建设减少了二氧化碳气体的排放,能减缓 的程度;自然界中消耗二氧化碳的主要途径是 ;请你写出一种日常生活中符合“低碳经济”理念的做法: 。
(2)法国化学家PaulSabatier采用“组合转化”技术使CO2和H2在催化剂作用下生成CH4和H2O。试写出该反应的化学方程式 。
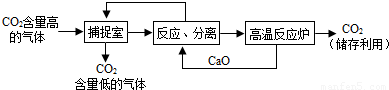
(3)近来有科学家提出利用“碳捕捉技术”来降低工业生产中二氧化碳的排放量。“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。常利用足量的NaOH溶液来“捕捉”CO2,过程如下图所示(部分条件及物质未标出)。
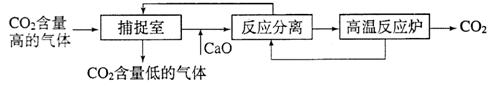 |
①捕捉室中发生反应的化学方程式为: 。
②把CaO放入反应分离室中与H2O反应,请写出该反应的化学方程式: ;利用此反应,氧化钙可用作食品 剂。
③“反应分离”中,得到固体物质的基本操作是 ,该固体是碳酸钙。
④整个过程中,可以循环利用的物质有 。
(4)取10g碳酸钙固体高温加热,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%,则下列判断正确的是
A.生成了2g二氧化碳
B.剩余固体质量为5g
C.生成了5.6g氧化钙
D.剩余碳酸钙的质量为8g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com