
题目列表(包括答案和解析)
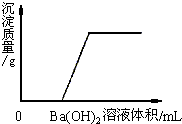 (2004?北京)某溶液由NaOH、HCl、稀H2SO4和MgCl2中的一种或几种组成.向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如下图所示.该溶液中不可能存在的物质是
(2004?北京)某溶液由NaOH、HCl、稀H2SO4和MgCl2中的一种或几种组成.向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如下图所示.该溶液中不可能存在的物质是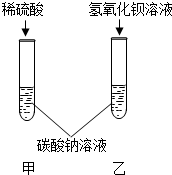 甲乙两同学为了验证碳酸钠的化学性质,做了如图所示的实验.乙同学的实验中发生反应的化学方程式为
甲乙两同学为了验证碳酸钠的化学性质,做了如图所示的实验.乙同学的实验中发生反应的化学方程式为| 实验方案 | 现象 | 结论 | |
| 甲同学 | 向试管中滴加石蕊溶液 | 溶液变红 溶液变红 |
猜想①正确 |
| 乙同学 | 向试管中滴加稀盐酸 | 无明显现象 | 猜想①正确 |
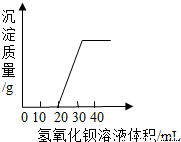

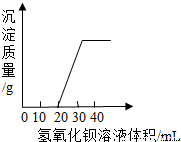
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com