
题目列表(包括答案和解析)
7.维生素C是生命活动中不可缺少的营养物质,不同的饮料中维生素C的含量不同。下面是小明同学运用学到的实验方法测定橙汁、果味饮料中维生素C的含量。![]() .
.
【实验目的】测定不同饮料中维生素C的含量。![]() .
.
【实验原理】![]() .(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色;
.(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色;![]() .
.
(2)淀粉遇到碘水变 色。![]() .
.
【实验试剂】碘水、淀粉溶液、已知浓度的标准维生素C溶液、蒸馏水![]() .
.
【实验过程】![]() 步骤1:在4支试管中分别盛有3.0 mL的下列物质:①蒸馏水,②标准维生素C溶液,
步骤1:在4支试管中分别盛有3.0 mL的下列物质:①蒸馏水,②标准维生素C溶液,![]() .③橙汁,④果味饮料。分别向4支试管中滴加2滴淀粉溶液。
.③橙汁,④果味饮料。分别向4支试管中滴加2滴淀粉溶液。![]() .
.
步骤2:用4支相同的胶头滴管分别向①~④支试管中逐滴滴加碘水至刚好变色,并记录滴数。![]() .
.
【实验记录】![]() .
.
| 测定物质 | ① | ② | ③ | ④ |
| 滴入碘水的数量(滴) | 1 | 8 | 15 | 5 |
试回答下列问题:![]() .
.
(1)你认为小明测定的两种饮料中, 的维生素C的含量较高;![]() .
.
(2)有的同学认为测定物质标准维生素C溶液是多余的,你认为呢?请说明理由: ![]() . ;
. ;![]() .
.
(3)化学实验需要控制变量。下列 (填序号)情况会影响到测定结果。![]() .
.
A.每次实验所用饮料的颜色不同 B.量取的被测试物质的体积不同![]() .
.
C.试管的大小不同 D.没有用同一规格的胶头滴管滴加碘水![]() .
.
【回顾与反思】实验中所用的淀粉溶液的作用是 。![]() .
.
(7分)利用金属及金属活动性顺序的有关知识解决下列问题。
(1)某兴趣小组的同学学习了金属的性质后,在实验室找到的一种银白色金属R做如下探究:
①将金属R投入稀盐酸中,金属表面有气泡冒出。则该金属R在金属活动性顺序表中排在氢的 (选填“前面”或“后面”)。
②将金属R投入到FeSO4溶液中,金属R表面有黑色物质析出。根据上述信息,判断金属Fe、R、Cu活动性由强到弱的顺序是 。
(2)工业生产中常用10%的稀盐酸来除铁制品表面的铁锈,写出盐酸除铁锈反应的化学方程式 ;若要配制该盐酸600g,则需要溶质质量分数为40%的浓盐酸(密度为1.2g/mL) mL。
(3)某校实验室废水中含有Zn(NO3) 2、AgNO3、Cu(NO3) 2三种物质。该校化学兴趣小组的同学为了从中分离、回收金属Ag和Cu,设计了如下实验方案(实验中未引进其它金属离子):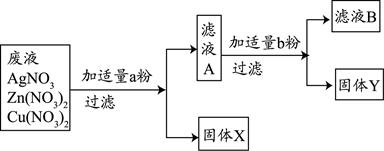
回答问题:
①固体X是 。
②写出实验过程中所发生反应的化学方程式 。
(7分) 利用金属及金属活动性顺序的有关知识解决下列问题。
(1)某兴趣小组的同学学习了金属的性质后,在实验室找到的一种银白色金属R做如下探究:
①将金属R投入稀盐酸中,金属表面有气泡冒出。则该金属R在金属活动性顺序表中排在氢的 (选填“前面”或“后面”)。
②将金属R投入到FeSO4溶液中,金属R表面有黑色物质析出。根据上述信息,判断金属Fe、R、Cu活动性由强到弱的顺序是 。
(2)工业生产中常用10%的稀盐酸来除铁制品表面的铁锈,写出盐酸除铁锈反应的化学方程式 ;若要配制该盐酸600g,则需要溶质质量分数为40%的浓盐酸(密度为1.2g/mL) mL。
(3)某校实验室废水中含有Zn(NO3) 2、AgNO3、Cu(NO3) 2三种物质。该校化学兴趣小组的同学为了从中分离、回收金属Ag和Cu,设计了如下实验方案(实验中未引进其它金属离子):
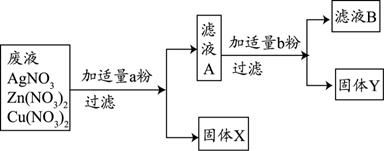
回答问题:
①固体X是 。
②写出实验过程中所发生反应的化学方程式 。
 (7分)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%.老师说,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
(7分)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%.老师说,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度 (t)/℃ |
25.2 | 29.6 | 32.0 | 36.0 | 38.2 | 36.7 | 35.7 | 34.7 | 33.7 | 32.9 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com