
题目列表(包括答案和解析)
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有 .
从实验现象可判断:金属活动性Zn Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是 .
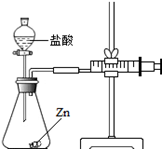
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是 .所用药品,实验数据如下表:
| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
 含钠元素、钙元素的化合物是初中化学的重要研究对象之一.
含钠元素、钙元素的化合物是初中化学的重要研究对象之一.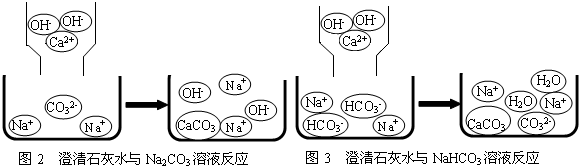
| 实验内容 | 实验现象 | 实验结论 |
| 方案一:取少量滤液加入试 管中,向其中 |
娇娇同学的猜想是正确的. 滤液中含有的两种溶质是 | |
| 方案二:取少量滤液加入试管中,向其中 |
 学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议
学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议 含钠元素、钙元素的化合物是初中化学的重要研究对象之一.
含钠元素、钙元素的化合物是初中化学的重要研究对象之一.
| 实验内容 | 实验现象 | 实验结论 |
| 方案一:取少量滤液加入试 管中,向其中______ | ______ | 娇娇同学的猜想是正确的. 滤液中含有的两种溶质是 ______ |
| 方案二:取少量滤液加入试管中,向其中______ | ______ |
 学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议______
学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议______
| 实验内容 | 实验现象 | 实验结论 |
| 方案一:取少量滤液加入试 管中,向其中______ | ______ | 娇娇同学的猜想是正确的. 滤液中含有的两种溶质是 ______ |
| 方案二:取少量滤液加入试管中,向其中______ | ______ |
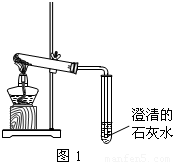
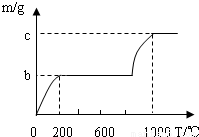
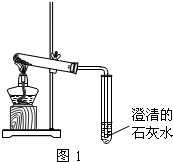
在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题.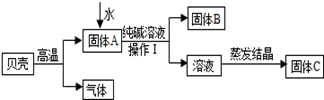
Ⅰ.定性研究
(1)生成固体B的化学反应方程式______________________________________________;
(2)操作Ⅰ指的是______________,其中要用到的玻璃仪器有烧杯、玻璃棒、 ;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是__________________。
【猜想与假设】小组同学根据实验流程对所得的固体C的组成提出了质疑:甲同学认为:可能是NaOH、Na2CO3;乙同学认为: 可能是 ; 丙同学认为:可能是NaOH
【交流与评价】请你把乙同学的可能猜想结果写在横线上;
【活动与探究】甲同学取原溶液向其中倾倒一定量的稀盐酸观察到有大量气泡产生,于是得出该溶液中的溶质是NaOH、Na2CO3的结论,证实了自己的猜想。
乙同学取原溶液向其中加入Na2CO3溶液无现象,据此否定了自己的猜想;他又重新取原溶液,向其中加入____________观察到与甲同学不同的现象,得出了和甲同学相同的结论。
丙同学为了验证上述结论也取原溶液向其中滴加了少量稀盐酸,却发现无气泡产生。
【解释与结论】大家经过分析找出了丙同学所用试剂与甲同学相同,却没有看到气泡的原因。你认为可能的原因是 。经过上述三位同学的共同努力,大家终于对溶液中溶质的成分得出了正确结论。
Ⅱ.定量探究
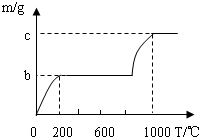
【提出问题】固体产品C氢氧化钠的质量分数是多少呢?
【设计实验】小组同学设计了两套不同的方案进行实验并测得数据如下: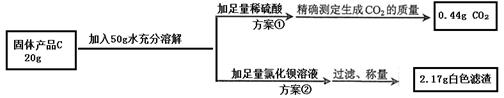
请你利用方案①所得数据计算固体产品C中氢氧化钠的质量分数(请列出计算过程)
【实验反思】
另一组同学根据方案②所得数据计算出的氢氧化钠质量分数与方案①相比明显偏小,请你分析其中的可能原因:_________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com