
题目列表(包括答案和解析)
| ||
| ||

| ||
| ||
| ||
| ||

| ||
| ||
 +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:| 测定时间/分钟 | 0 | 1 | 2 | 3 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
一、选择题(本大题共10题,每小题2分,共20分)每小题给出的四个选项中,只有一个最符合题意,请将其序号涂在答题卡上。
题号
1
2
3
4
5
6
7
8
9
10
答案
D
C
B
B
C
A
B
C
D
C
二、选择题(本大题共5题,每小题2分,共10分)每小题给出的四个选项中,有1~2个符合题意。只有一个选项符合题意的多选不给分;有2个选项符合题意的只选一个且符合题意给1分,若选2个有一个不符合题意则不给分。
题号
11
12
13
14
15
答案
C
D
BD
B
A
三、(本大题共5题 共22分)
16.(4分)(每空1分)①Na2CO3 ②NaCl ③CH4 ④H2O。
17.(4分)(每空1分)①Fe ②2O2 ③SO42- ④Mg(NO3)2
18.(6分)(每空1分,化学方程式2分) (1) A、B、C、D;C、D;(2)C;用砂纸打磨;6HCl + Fe2O3== 2FeCl3 +3H2O[或3H2SO4+Fe2O3==Fe2(SO4)3+3H2O]
19.(5分)(每空1分)(1)蛋白质、糖类、油脂;蛋白质;(2)元素;(3)20mg;(4)
20.(3分)(每空1分)31 B 质子数不同(或核电荷数不同)
四、(本大题共5题 共38分)
21.(8分)(每个化学方程式2分)(1)CaO+H2O==Ca(OH)2
(2)Fe2O3+6HCl==2FeCl3+3H2O
(3)
(4)
22.(5分)(每空1分)(1)t
23.(5分)(每空1分)(1)CO2(2)CO2、H2、CO CO2、CH4、H2 CO2、CH4、CO CO2、CH4
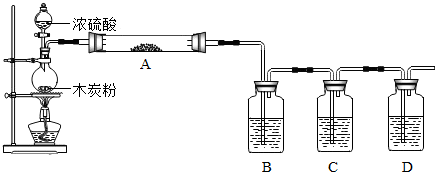
24.(11分)(每空1分)(1)①漏斗;;②a、d。(2)①E;②B(1分);试管破裂(1分);③A;D或F;
④浓H2SO4;b;a;瓶内装入NaOH溶液,用于除去气体中的CO2(此答案不唯一)
25.(9分)(每空1分,化学方程式2分)(1)氧化铜 氧化铜与碳粉的混合物
(2)有黑色不溶物,溶液为无色 黑色物质溶解,溶液为蓝色 有黑色不溶物,溶液为蓝色(3)有 H2SO4 CuO+ H2SO4= CuSO4 +H2O
五、(本大题共2题 共10分)
26.(3分)(每空1分)(1) 60 ;(2) 3?4?7?1 ;(3) 23.15 。
27.(7分)解:(1)设原混合物中镁的质量为x,
则Mg+H2SO4=MgSO4+H2↑
24 2
x
24:x=2:
x=
Mg%=80% (1分)
(2)首先中和未反应的H2SO4 H2SO4+2NaOH=Na2SO4+2H2O
然后再发生如下反应 ,MgSO4+2NaOH=Na2SO4+Mg(OH)2↓ (1分)
即NaOH全部转化为Na2SO4 设最终所得Na2SO4的质量为y,
2NaOH ~ Na2SO4
80 142
80:
y=
根据质量守恒定律,反应所得溶液质量为
100+80+1.2―0.1―2.9=
则Na2SO4%≈7.97% (1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com