
题目列表(包括答案和解析)




















现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
![]()
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
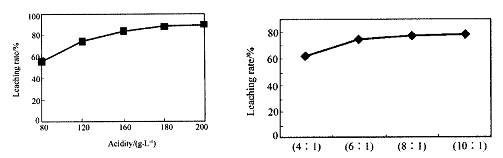
图1酸度对铟浸出率的影响 图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
2ZnS +3O22ZnO+2SO2; 鼓风炉中:2C +O2
2CO ZnO+CO
Zn + CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
图1酸度对铟浸出率的影响 图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:
①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
(8分)现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。
主要反应为:2ZnS +3O22ZnO+2SO2 ;鼓风炉中:2C+O2
2CO
鼓风炉中:ZnO+COZn + CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为: 、 。
(2)湿法炼锌的主要工艺流程为
①硫酸浸取的主要反应的离子方程式为: 。
②从保护环境和充分利用原料角度,如何处理或利用烟气 。
③除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
④酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式 ___________ 、 。
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
图1酸度对铟浸出率的影响 图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:
①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
1―5 CBABD 6―9CBBB
10.答案:饱和溶液的物质的量浓度为:
析出晶体(不含结晶水)的质量为
11.答案
(1)该反应是放热反应
2Na2O2 + 2H2O = 4NaOH + O2↑
(2)打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成。
将导管Q浸入水中,反应过程中导管口有气泡冒出。
(3)溶液先变红后褪色。
(4)7.5%
(5)
实验操作
实验现象
结论
向盛有约2 ml 5%的H2O2溶液的试管中滴加入少量的
2 mol/L H2SO4,并把带火星的木条伸入试管。
无明显现象
起催化作用的不是SO42-
向盛有约2 ml 5%的H2O2溶液的试管中滴加入少量CuSO4溶液4,并把带火星的木条伸入试管。
试管中有大量气泡产生,带火星的木条复燃。
起催化作用的是Cu2+
12.答案
(1)药匙
(2)该混合物中肯定含有NH4HCO3,肯定不含有CuSO4 。
(3)
实验操作
预期现象和结论
向溶液B中滴加少量Ba(NO3)2溶液。
如果产生白色沉淀,说明原固体混合物中含有K2SO4;
如果没有白色沉淀产生,说明原固体混合物中不含K2SO4,(含有NaCl或NH4Cl。)
若固体混合物不含K2SO4(该句可以不写),取少量原固体混合物于试管底部, 将试管套入试管夹,用火柴点燃酒精灯,充分加热试管。
如果试管底部有固体残留,说明混合物中含有NaCl;
如果试管底部无固体残留,说明混合物中含有NH4Cl;
以下回答同样得分:
实验操作
预期现象和结论
取少量原固体混合物于试管底部,
将试管套入试管夹,用火柴点燃酒精灯,充分加热试管。
如果试管底部有固体残留,说明混合物中含有K2SO4或NaCl;
如果试管底部无固体残留,说明混合物中含有NH4Cl;
如果加热后试管底部有固体残留(该句可以不写),取残留固体加水溶解,滴加少量Ba(NO3)2溶液。
如果产生白色沉淀,说明原固体混合物中含有K2SO4;
如果没有白色沉淀产生,说明原固体混合物中含有NaCl。
13.答案
(1) ① 
图中要标明2、4、6 min时刻时的速率及要画出速率走向弧线
②镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4 min后由于溶液中H+浓度降低,所以导致反应速率减小。
(2)①原因Ⅱ:Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
原因Ⅴ:Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大)。
②反应速率加快; 反应速率减慢。
14.答案
(1) ①②④
(2)
(3) 
(4) 加成反应 水解(取代)反应
(5) 
15.答案:
(1)
(2)C 浓硫酸有吸水性,减小水的浓度有利于平衡向右移动。
(3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com