
2.(2000年全国春季高考)浓度均为0.1 mol·L-1的甲酸和氢氧化钠溶液等体积相混合后,下列关系式正确的是
( )
A.(Na+)>c(HCOO-)>c(OH-)>c(H+)
B.c(HCOO-)>c(Na+)>c(OH-)>c(H+)
C.c(HCOO-)=c(Na+)>c(H+)=c(OH-)
D.c(Na+)=c(HCOO-)>c(OH-)>c(H+)
(本题考查了学生对弱酸强碱盐的水解规律的掌握)
1.(2003·全国高考江苏卷)将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是 ( )
A [HCN]<[CN-] B [Na+]>[CN-]
C [HCN]-[CN-]=[OH-]
D [HCN]+[CN-]=0.1mol·L-1
(本题考查学生对盐溶液中离子之间的几种守恒关系--即物料守恒、电荷守恒)
2.与盐类水解有关的应用
⑴湿施化肥; ⑵泡沐灭火器; ⑶制备氢氧化铁胶体;⑷比较盐溶液的PH值大小;⑸判断溶液中离子浓度大小;⑹判断离子是否共存;⑺判断溶液酸碱性;⑻配制盐溶液;⑼明矾的净水;⑽试剂的贮存;⑾物质的鉴别;⑿热碳酸钠溶液的洗涤力强;⒀氯化铵溶液中加入镁粉产生氢气。
典型题点击
1. 盐类的水解
⑴盐类水解的实质
在溶液中由盐电离出的弱酸的阴离子或弱碱的阳离子跟水电离出的氢离子或氢氧根离子结合生成弱电解质,从而促进水的电离。
其实是在溶液中,盐的离子破坏了水的电离平衡,使其平衡向右移动,引起氢离子或氢氧根离子浓度的变化。使溶液显示出不同程度的酸性、碱性和中性。
⑵水解规律
①通常盐类水解程度是很小的,且反应前后均有弱电解质存在,所以是可逆反应
②水解规律:无弱不水解,有弱就水解,越弱越水解,都弱双水解,谁强显谁性。
I.组成盐的弱碱阳离子能水解显酸性,组成盐的弱碱的阴离子能水解显碱性。
II.盐对应的酸(或碱)越弱,水解程度越大,溶液碱性(或酸性)越强。
III.多元弱酸根,正酸根离子比酸式酸根离子水解程度大得多,如CO32-比HCO3-的水解程度大,溶液的碱性更强。
⑶.影响水解的因素:
①内因:盐的离子与水中的氢离子或氢氧根离子结合的能力的大小,组成盐的酸或碱的越弱,盐的水解程度越大。
②外因:
温度:由于水解反应是中和反应的逆反应,而中和反应是放热反应,因此,水解反应是吸热反应。所以,升高温度会使盐的水解程度增大。
浓度:溶液浓度越小,实际上是增加了水的量,可使平衡相正反应方向移动,使盐的水解程度增大。(最好用勒沙特例原理中浓度同时减小的原理来解释)。
24. (1)AgCl饱和所需Ag+浓度[Ag+]1=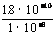 =1.8×10-7摩/升
Ag2CrO4饱和所需Ag+浓度[Ag+]2=
=1.8×10-7摩/升
Ag2CrO4饱和所需Ag+浓度[Ag+]2= =4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时c(Cl-)=
=4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时c(Cl-)= =4.13×10-6<10-5,所以能有效地分离。
=4.13×10-6<10-5,所以能有效地分离。
23.(1)0.025mol/L (2)c(Ba2+)=0.025mol/L
c(Na+)=0.05
mol/L c(HCO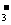 )=1mol/L
)=1mol/L
22.(1)1 (2)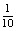 (3)10x+y-14,>
(3)10x+y-14,>
21.a+b= 13 讲析:因混和溶液呈中性,则原强酸溶液中H+数与原强碱溶液中OH-数相等,由此1 ⅹ10-a=10ⅹ10-14+b,对上述等式两边取对数,即lg(1 ⅹ10-a )= lg(10ⅹ10-14+b) 得a+b= 13。
20.3-5 讲析:“某酸” 若为为强酸溶液,则稀释100倍后,PH值增大2个单位,即为5;若为弱酸,则稀释后的[H+]=10-3ⅹ10-2ⅹα1/α2,PH=5-lg(α1/α2),因α1<α2,故PH=5-lg(α1/α2)<5
19.2.9ⅹ10-3g 讲析:设溶液为1L,由PH值可知1L溶液中所溶解的Mg(OH)2的质量,进而根据溶解度的概念,求得100g水中所溶解Mg(OH)2的质量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com