
3.(1)Fe2(SO4)3、Na2SO4 (2)催化剂、适宜温度
(3)Fe2O3+6H+=2Fe3++3H2O
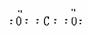 讲析:由G和KSCN溶液混合后溶液显血红色,可知G中含有Fe3+。A是硫酸盐,A和G元素组成相同,则G为Fe2(SO4)3,A为FeSO4。硫酸亚铁受热分解产生B、C、D,且C和D元素组成相同,C与O2反应转化为D,C、D中都含氧元素,C与H2O能反应,可确定C为SO3,D为SO2,其他问题可迎刃而解。
讲析:由G和KSCN溶液混合后溶液显血红色,可知G中含有Fe3+。A是硫酸盐,A和G元素组成相同,则G为Fe2(SO4)3,A为FeSO4。硫酸亚铁受热分解产生B、C、D,且C和D元素组成相同,C与O2反应转化为D,C、D中都含氧元素,C与H2O能反应,可确定C为SO3,D为SO2,其他问题可迎刃而解。
2.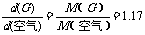 (1)Ⅲ族和Ⅵ族 (2)Al2S3 (3)2/3mol
(1)Ⅲ族和Ⅵ族 (2)Al2S3 (3)2/3mol
讲析:因
故M(G)=1.17×29=34,初步假定气体G为H2S(相对分子质量为34)。按题中框图,逆向推断,调用自己掌握的有关化学知识,尝试写出相应的反应方程式,即可求证。
如果对有关元素及其化合物的性质掌握较熟悉,而对空气的平均相对分子质量为29记忆不清,按题图示,正向演绎,也可殊途同归,得出正确解答的。
1.A:NH3·H2O,D:Al2(SO4)3,E:NaHCO3,F:NaOH,B:MgCl2,C:稀H2SO4
讲析:此题的突破口是实验(3)中的现象,由此可知E,D分别是Al2(SO4)3和NaHCO3中的一种。由限定的推断范围可知,实验(2)中放出的无色刺激性气味的气体必是NH3,则F应为NaOH,D与A的反应中必有NH4+生成。
4.(1)H2 (2)H2O (3)②,④
2NaCl + 2H2O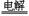 2NaOH+ H2↑+ Cl2↑
2NaOH+ H2↑+ Cl2↑
2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
讲析:根据已学的知识,常见的工业生产反应有:煅烧石灰石、生产玻璃和水泥、接触法制硫酸、氨氧化制硝酸、氯碱工业等。结合反应条件和反应类型可知,作为工业上生产化合物D的反应①,高温下的分解反应为煅烧石灰石生产生石灰的反应。反应②为电解条件下,两种反应物和三种产物,则溶质和溶剂都参与反应,且产物中有两种单质,联想到电解食盐水的氯碱工业,此题不难解决。
新活题网站
3.(1)N2 O2
(2)N2 + 3Mg Mg3N2
Mg3N2
(3)O2 + 2H2 2H2O
2H2O
[或答:(2),N2 + 3H2 2NH3
2NH3
(3)O2 + 2Mg 2MgO。]
2MgO。]
讲析:甲、乙、丙、丁均为单质,由它们两两相互反应所得到的X、Y、Z、W都是二元化合物。条件②是解本题的突破口。甲和丁按1:3物质的量之比反应生成Y,在Y中元素甲呈负价。由此可联想到所熟悉的合成氨的反应:
N2
+ 3H2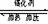 2NH3
2NH3
可暂时先认为甲就是N2,丁是H2。甲和丙也按1:3物质的量之比反应生成X,在X中元素甲呈负价,因此,可判断元素丙在X中呈正价;于是可以设想元素丙为金属元素。与氮按3:1物质的量之比反应的金属,中学所学过的前三周期元
素中,应当是金属镁。甲与丙反应生成X的化学方程式为:
N2 + 3Mg Mg3N2
Mg3N2
从以上分析,可以认定甲是N2,丁是H2,丙是Mg;再考虑题给条件③,容易判断乙是O2。于是,乙与丁反应生成W的化学方程式是:
O2 + 2H2 2H2O
2H2O
上述讨论中,若将丙和丁所代表的物质调换一下,仍可满足题意,故有两种可能的正确答案。
2.(1)Cl(或氯) K(或钾)
(2)Cl2+2KOH=KCl+KClO+H2O
(3)2KClO3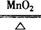 2KCl +
3O2↑
2KCl +
3O2↑
1.C
讲析: H2SO4和HNO3的酸酐分别为SO3、N2O5,这两种氧化物不能由单质直接化合获得,选C。
9.(1)①旧金属的收集;②与其他废物的分离;③回收和提炼金属的费用;④金属本身的价值;⑤人们的环境意识薄弱。
(2)①金属本身的价值;②金属的活动性。
 (3)①Al2O3+2NaOH=2NaAlO2+H2O
(3)①Al2O3+2NaOH=2NaAlO2+H2O
②NaAlO2+CO2+2H2O= A1(OH)3↓+NaHCO3
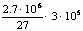 ③2A1(OH)3 Al2O3+
3H2O
③2A1(OH)3 Al2O3+
3H2O
(4)W=QU=6× =1.8×1011J=1.8×108kJ
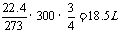 (5)每产生1molAl,则产生0.75molO2,换算为非标况下有:V(O2)=
(5)每产生1molAl,则产生0.75molO2,换算为非标况下有:V(O2)=
8.A:K;B:Cu;C:Ag;D:Zn;E:Fe;F:Pt;G:Sn
1.D 2.B 3.B 4.C 5.D 6.B 7.A
讲析:2. A不正确,对于变价金属离子较低价态(如Fe2+)的既有氧比性又有还原性。少数金属在常温下为非晶体,如Hg。
讲析:3.只要了解Ca是人体骨骼的组成元素,而Fe是人体血红蛋白的组成元素之一。不要将二者混淆。
讲析:4.根据金属活泼性强弱的判断规律:①能在水溶液中发生置换反应。一定X>Y,且均不是A1以前的金属;②与冷水反应放出H2,为活泼金属;③原电池中负极活泼,M>N;④Y可与稀H2SO4反应,M不能,则:Y>M。故答案为C。
讲析:5.首先明确要比较的三种物质的晶体类型,铝、铝硅合金为金属晶体,而硅是原子晶体,熔点最高,又因合金的熔点比各成分熔点都低,从而选出答案 D。
讲析:6.0.02mol甲放入1L0.01mol/L的盐酸中,盐酸不足,放出H2取决于酸的量,但过量的Na、K能与水反应放出H2。放出H2量:A=B=D>C。再加入0.01mol乙,Mg与碱不反应,0.01molAl与碱(NaOH过量)反应产生0.15molH2,0.01molNa、0.01molK与水反应只产生0.005molH2。故B选项产生H2最多。
注意Al与NaOH溶液反应要放出H2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com