把4.1g铁和锌混合物放在稀硫酸中完全溶解,制得0.14g氢气.混合物中锌的质量分数是( )
A.32%
B.68%
C.16%
D.35%
【答案】
分析:根据金属的活动性顺序及金属的性质可以知道,锌和铁都能够和稀硫酸反应生成氢气,根据它们和硫酸反应的化学方程式结合生成氢气的质量可以求算出混合物中铁和锌的质量.
解答:解:设混合物中锌的质量为x,锌和硫酸反应生成氢气的质量为y,则:
Zn+H
2SO
4 ═ZnSO
4+H
2↑
65 2
x y
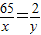
解得:y=
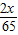
设混合物中铁的质量为m,铁和硫酸反应生成氢气的质量为n,则:
Fe+H
2SO
4═FeSO
4+H
2↑
56 2
m n
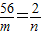
解得:n=
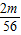
所以:x+m=4.1g…①
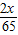
+
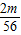
=0.14g…②
解得:x=1.3g
所以其中锌的质量分数为:
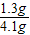
×100%=32%.
分析所给选项可以知道选项A是正确的.
故选A.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景结合所学的相关知识和技能,细致地分析题意并细心地探究,按照题目要求进行认真地选择或解答即可.

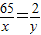
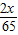
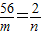
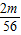
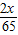 +
+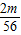 =0.14g…②
=0.14g…②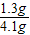 ×100%=32%.
×100%=32%.
