化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:
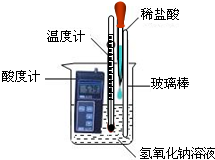
(1)甲组同学取少量的氢氧钠溶液于烧杯中,用酸度计测得该溶液的pH
(选填“<”、“>”或“=”)7,同时插入一支温度计,测量溶液的温度(如下图所示).用胶头滴管吸取稀盐酸,逐滴加入盛有氢氧化钠溶液的烧杯中,边滴加边搅拌.此时可观察到的现象是:酸度计上显示的数据逐渐
(选填“增大”、“减少”或“不变”,下同),温度计上显示的数据逐渐
.由此可知,酸和碱的中和反应属于
(选填“吸热”或“放热”)反应.该反应的化学方程式
.
(2)乙组的同学改用固体氢氧化钠与稀盐酸反应来探究中和反应中能量的变化情况,你认为该方案
(选填“合理”或“不合理”),理由是
.
(3)丙组同学用另外一瓶氢氧化钠溶液进行实验时,当往烧杯中滴加稀盐酸时,发现有少量的气泡冒出,小组同学根据这一现象进行讨论,一致认为其原因可能是氢氧化钠溶液已经变质,变质的原因是
,由此,同学们建议实验室保存氢氧化钠时应注意
保存.为了除去氢氧化钠溶液中变质产生的碳酸钠,你认为可选用下列物质中的
(填序号).
A.稀盐酸 B.氢氧化钙溶液 C.氯化钙溶液 D.氯化钠溶液
(4)丁组同学借助酚酞试液来判断氢氧化钠溶液与稀盐酸发生中和反应时,向烧杯中的氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记了滴加酚酞试液.为了确定盐酸与氢氧化钠是否恰好完全反应,小组的同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴酚酞试液,振荡,观察到酚酞试液不变色.于是他们得出了“两种物质已恰好完全中和”的结论.你认为他们得出的结论是否正确?
,
理由是:
.
请你帮助该小组的同学设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填
写下表:
(5)实验室现有一瓶久置的20%的氢氧化钠溶液100g.某同学取该溶液的1/10于锥形瓶中,滴加1-2滴酚酞试液,然后滴入稀盐酸,边加边振荡.当反应恰好完全时,用去稀盐酸的体积为17.40mL.
已知:常温下,所用稀盐酸的密度为1.05g/cm
3.
①计算所用稀盐酸的溶质质量分数.(计算结果精确到1%)
②已知用此方法测得的稀盐酸的溶质质量分数有误差.若该同学的实验操作及计算过程均无误,则造成该误差的原因之一可能是
.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案 化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:
化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究: