“用双氧水和二氧化锰制氧气”的反应方程式为:______ 2H2O+O2↑
【答案】
分析:根据方程式的写法写出方程式;(1)根据对图表中数据的分析考虑;(2)根据观察过氧化氢溶液浓度越大,收集气体用的时间多少和溶液温度的高低考虑;(3)根据反应物接触面积越大反应越剧烈考虑.
解答:解:用双氧水和二氧化锰制氧气的反应物是过氧化氢,生成物是水和氧气,反应条件是二氧化锰作催化剂,用观察法配平,氧气后面标上上升符号;
(1)根据图表中数据可知,当催化剂MnO
2的用量增加时,收集到500mL氧气时所用的时间越来越短,即反应速度越来越快;增加到0.8g后反应速度不再改变了;
(2)由图表中数据可知H
2O
2溶液的溶质质量分数越大,收集到540mL气体时所用时间越短,即反应速度越快;随着反应的进行,溶液温度越来越高,所以该反应是放热反应;
(3)煤制成蜂窝状比煤球易燃烧些,主要原因是增大了煤与空气的接触面积,所以接触面积越大反应越剧烈.
故答案为:2H
2O
2 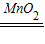
2H
2O+O
2↑;(1)加快;不变;(2)质量分数越大,反应速率越大;放热;(3)接触面积越大,反应越快.如煤制成蜂窝状后易燃烧些(或纸张撕碎后易燃烧些等合理答案均可).
点评:解答本题关键是要知道方程式的书写方法,知道反应速度的影响因素有:温度,反应物浓度,反应物的接触面积,知道根据图示数据分析问题的方法.

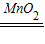 2H2O+O2↑;(1)加快;不变;(2)质量分数越大,反应速率越大;放热;(3)接触面积越大,反应越快.如煤制成蜂窝状后易燃烧些(或纸张撕碎后易燃烧些等合理答案均可).
2H2O+O2↑;(1)加快;不变;(2)质量分数越大,反应速率越大;放热;(3)接触面积越大,反应越快.如煤制成蜂窝状后易燃烧些(或纸张撕碎后易燃烧些等合理答案均可).





