
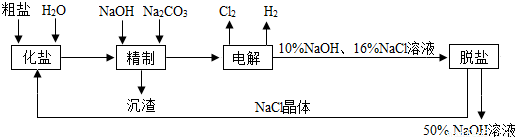
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
| NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
| NaOH溶解度/g | 42 | 51 | 109 | 119 | 129 | 145 | 174 | 299 | 314 | 329 | 347 |
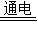 2NaOH+H2↑+Cl2↑.(通电是条件,电解是过程和操作,注意区别)
2NaOH+H2↑+Cl2↑.(通电是条件,电解是过程和操作,注意区别)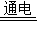 NaClO+H2↑..
NaClO+H2↑..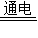 2NaOH+H2↑+Cl2↑;(2)ac; (3)bc; (4)蒸发结晶;(5)NaCl+H2O
2NaOH+H2↑+Cl2↑;(2)ac; (3)bc; (4)蒸发结晶;(5)NaCl+H2O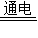 NaClO+H2↑.
NaClO+H2↑.

科目:初中化学 来源: 题型:
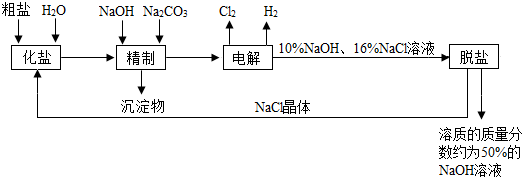
查看答案和解析>>
科目:初中化学 来源: 题型:
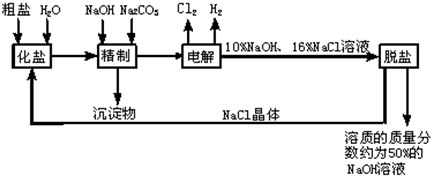
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
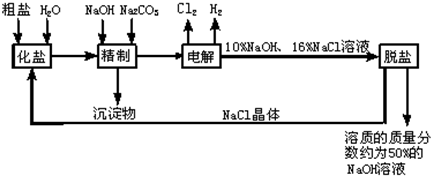
查看答案和解析>>
科目:初中化学 来源:2011年江苏省无锡市育才中学中考化学二模试卷(解析版) 题型:填空题
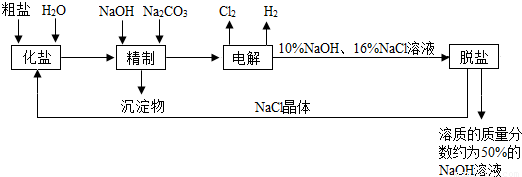
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com