
如图所示,是某校研究性学习小组模拟池塘生态系统
制作的一个封闭生态瓶
(瓶中生物生长良好),请据图回答:
(1)该生态瓶中属于生产者的是________.
(2)该生态瓶放置在明亮的街台上(天气晴朗并不采用其他光源),那么生态瓶中早晨水溶液的pH_______(填“<7”“=7”或“>7”),傍晚时水溶液的pH______
(填“<7”“=7”或“>7”);理由是________.
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| 时间 | 6:30 | 11:30 | 16:30 | 20:30 |
| 气温(℃) | 25 | 28 | 3l | 27 |
| 氧气的含量(mg/L) | 7.0 | 10.2 | 12.7 | 6.8 |
| 地点 | 造纸厂的排污口 | 菜市场的下水道 | 家中自来水 | 有水中植物的人工湖 |
| 氧气的含量 (mg/L) |
0.2 | 1.2 | 5.0 | 11.8 |

查看答案和解析>>
科目:初中化学 来源: 题型:
 (1)化石燃料包括
(1)化石燃料包括 A.红磷、白磷均为可燃物;
A.红磷、白磷均为可燃物;查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
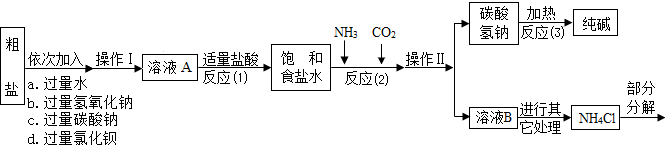
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:新课标教材典型例题详解 九年级化学 全 题型:058
课题式学习是研究性学习的一种方式,其基本学习模式为
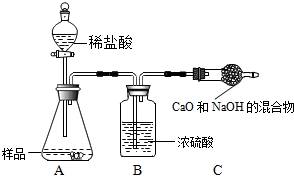
某校研究性学习小组的同学在“一氧化碳的化学性质”的学习中设计了证明
CO具有还原性的实验装置(如图甲),根据其研究过程请你回答下列问题:
(1)实验过程中,洗气瓶A中的实验现象________.
(2)小徐同学认为此装置有待优化,如尾气可先储存在瓶内,然后再处理.如图所示乙是他设计的贮气瓶,尾气应从________(选a,b填空)口通入.
(3)小徐同学质疑CO能否使澄清石灰水变浑浊?因此进行设计:在CO通入CuO之前先通过澄清石灰水(即在盛CuO的硬质玻璃管的左端再接入一个盛澄清石灰水的洗气瓶)来确定CO能否使澄清石灰水变浑浊.请判断小徐的设计是否有必要,并说明理由________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com