化学物质之间的反应奥妙无穷.在一次化学探究活动中,同学们从不同角度对稀硫酸与氢氧化钠溶液的反应进行了探究,请你参与并填写以下空白.
(1)如何用实验验证稀硫酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
| 实验步骤 |
实验现象 |
结论 |
| 先用PH试纸测定稀硫酸的PH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的PH. |
PH逐渐变大,
最后 PH≥7 |
稀硫酸与氢氧化钠溶液能发生反应 |
①请你分析上述方案中为什么强调只有测得的PH≥7才能证明反应发生了?
排除因氢氧化钠溶液的加入,稀释硫酸而引起PH变大
排除因氢氧化钠溶液的加入,稀释硫酸而引起PH变大
或只有PH≥7才能说明硫酸已经反应掉了
或只有PH≥7才能说明硫酸已经反应掉了
.
②写出稀硫酸与氢氧化钠溶液反应的化学方程式
2NaOH+H2SO4=Na2SO4+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
.
(2)设计实验,探究稀硫酸与氢氧化钠溶液的反应是否放热
实验仪器与药品:10%的硫酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
请你完成实验方案设计:
| 实 验 步 骤 |
实验现象 |
结论 |
|
|
稀硫酸与氢氧化钠溶液反应放热 |
(3)探究稀硫酸与氢氧化钠溶液是否恰好完全反应
第二组同学在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应.
设计了实验方案二:
| 实验步骤 |
实验现象 |
结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. |
若 生成蓝色沉淀 生成蓝色沉淀 |
氢氧化钠溶液过量 |
| 若没有明显现象 |
稀硫酸与氢氧化钠溶液恰好完全反应 |
此时有同学提出方案二不能证明稀硫酸与氢氧化钠溶液恰好完全反应,其原因是
若盐酸过量,加入硫酸铜溶液时也无明显现象(或硫酸可能有剩余);
若盐酸过量,加入硫酸铜溶液时也无明显现象(或硫酸可能有剩余);
.为此,还需要选择
紫色石蕊试液(或锌粒、碳酸钠、氧化铜、氢氧化铜、pH试纸等).
紫色石蕊试液(或锌粒、碳酸钠、氧化铜、氢氧化铜、pH试纸等).
(填一种试剂),再进行实验即可.
能力提升:
某地新建一化工厂有一种产品属于“复盐”,该产品可用作铁树、棕榈等花木的肥料.某化学课外兴趣小组探究该产品的组成,进行了如下的实验:(查阅资料获知:“复盐”是指由两种阳离子和一种酸根离子组成的盐.如光卤石(KCl?MgCl
2?6H
2O)).
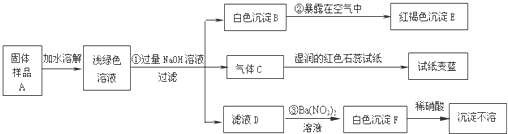
试回答下列问题:
(1)写出下列物质的化学式:C
NH3
NH3
、E
Fe(OH)3
Fe(OH)3
、F
BaSO4
BaSO4
(2)写出下列变化的化学方程式:
②
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
③
Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3
Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3
(3)上述探究结果说明样品A中含有的离子有
Fe2+、NH4+、SO42-
Fe2+、NH4+、SO42-
.

 阅读快车系列答案
阅读快车系列答案






