【答案】
分析:根据质量守恒定律中原子个数在反应前后相等来配平,常用最小公倍数法、观察法、待定系数法等.
解答:解:(1)Fe
2O
3+CO

Fe+CO
2,先由铁原子个数相等得到Fe
2O
3+CO

2Fe+CO
2,再利用氧原子个数的最小公倍数为6,配平二氧化碳的系数,
得到Fe
2O
3+CO

2Fe+3CO
2,再根据C原子和O原子个数前后相等可知CO的系数为3,即配平后的反应方程式为:Fe
2O
3+3CO
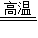
2Fe+3CO
2;
故答案为:3、2、3;
(2)将甲烷的系数定为1,则二氧化碳的系数为1,水的系数为2,得到CH
4+O
2
CO
2+2H
2O,再利用O原子个数前后相等,则氧气的系数为2,即
配平后的反应方程为CH
4+2O
2
CO
2+2H
2O;故答案为:2、2;
(3)根据O原子个数前后不相等,利用其最小公倍数为2可知氧化镁的系数为2,得到Mg+CO
2
2MgO+C,再利用镁原子个数前后相等,则镁的系数为2,
即配平后的化学反应方程式为:2Mg+CO
2 
2MgO+C;故答案为:2、2;
(4)因反应物只有一种,可将碱式碳酸铜的系数定为1,根据铜原子守恒则氧化铜的系数2,即配平后的反应方程式为:Cu
2(OH)
2CO
3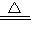
2CuO+H
2O+CO
2↑;
故答案为:2.
点评:本题考查学生对于化学反应方程式利用质量守恒定律来配平的掌握,学生应注意灵活应用,不要拘泥于某一方法,在配平时要多种方法并用,以达到快速解题的作用.

 Fe+ CO2
Fe+ CO2 CO2+ H2O
CO2+ H2O MgO+C
MgO+C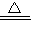 CuO+H2O+CO2↑
CuO+H2O+CO2↑  Fe+CO2,先由铁原子个数相等得到Fe2O3+CO
Fe+CO2,先由铁原子个数相等得到Fe2O3+CO 2Fe+CO2,再利用氧原子个数的最小公倍数为6,配平二氧化碳的系数,
2Fe+CO2,再利用氧原子个数的最小公倍数为6,配平二氧化碳的系数, 2Fe+3CO2,再根据C原子和O原子个数前后相等可知CO的系数为3,即配平后的反应方程式为:Fe2O3+3CO
2Fe+3CO2,再根据C原子和O原子个数前后相等可知CO的系数为3,即配平后的反应方程式为:Fe2O3+3CO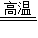 2Fe+3CO2;
2Fe+3CO2; CO2+2H2O,再利用O原子个数前后相等,则氧气的系数为2,即
CO2+2H2O,再利用O原子个数前后相等,则氧气的系数为2,即 CO2+2H2O;故答案为:2、2;
CO2+2H2O;故答案为:2、2; 2MgO+C,再利用镁原子个数前后相等,则镁的系数为2,
2MgO+C,再利用镁原子个数前后相等,则镁的系数为2, 2MgO+C;故答案为:2、2;
2MgO+C;故答案为:2、2; 2CuO+H2O+CO2↑;
2CuO+H2O+CO2↑;

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案