
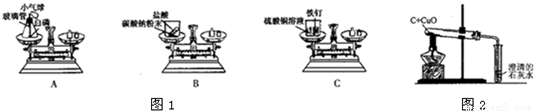
 2Cu+CO2↑;
2Cu+CO2↑; 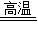 2Cu+CO2↑;②a、H2SO4;木炭、Cu;b、CuSO4、H2SO4;
2Cu+CO2↑;②a、H2SO4;木炭、Cu;b、CuSO4、H2SO4;

科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
 (2006?顺义区二模)如图1是a、b、c三种固体物质的溶解度曲线,根据曲线回答下列问题:
(2006?顺义区二模)如图1是a、b、c三种固体物质的溶解度曲线,根据曲线回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||

| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,放入几粒锌粒 | 溶液中产生气泡 | 硫酸过量 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 物质 | A | B | C | D |  --氢原子 --氢原子 --氧原子 --氧原子 --硫原子 --硫原子 |
| 微观示意图 |  |
 |
 |
 |
| 1 |
| 49 |
查看答案和解析>>
科目:初中化学 来源: 题型:

 ”微粒.
”微粒.
| 物质 | A | B | C | D |  |
| 微观示意图 |  |
 |
 |
||
| 反应前质量/g | 100 | 1 | 1 | 46 | |
| 反应后质量/g | 4 | 89 | 55 | x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com