
(10分)实验室用浓盐酸和MnO2制取并探究Cl2(氯气)化学性质,装置如下:

(1)A是Cl2发生装置,请完成反应的方程式:MnO2 +4HCl(浓)  ( )+ Cl2↑+2H2O;除圆底烧瓶外还用到的玻璃仪器有
。
( )+ Cl2↑+2H2O;除圆底烧瓶外还用到的玻璃仪器有
。
(2)从C装置出来的气体中含有CO2和HCl,写出C中反应的化学方程式____________。
(3)在实验中发现:若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成。“影响氯气生成的原因是什么呢?”小明作了如下探究:
①提出合理假设
假设1:Cl–的浓度对反应的影响;假设2:
②设计实验方案,进行实验。请在答题卡上写出实验步骤和预期现象及结论。限选实验试剂:浓H2SO4、NaCl固体、MnO2固体、稀盐酸
|
实验序号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
科目:初中化学 来源: 题型:
)回收的废旧锌锰于电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如下图所示。
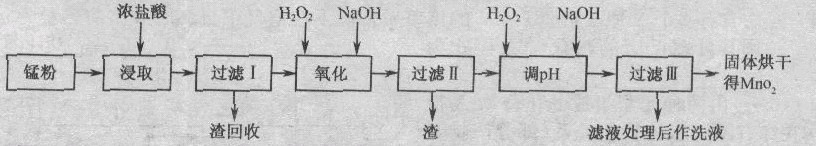
根据上图所示步骤并参考表格数据,回答下列问题。
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程式为________________________________。
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是__________________________。
(3)过滤I所得滤液经氧化后,需加入NaOH溶
液调节pH约为5.1,其目的是______________________________________。
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离于方程式为__________________________________________。
(5)实验室进行过滤操作时.需要用到的玻璃仪器有___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com