
| 物质 | 杂质 | 除去杂质的方法 | |
| A | CaO | CaCO3 | 加入足量的水溶解、过滤 |
| B | NaOH溶液 | Na2CO3 | 加入适量的Ca(OH)2溶液,过滤 |
| C | Cu(NO3)2溶液 | AgNO3 | 加入过量的铜粉,过滤 |
| D | CO | CO2 | 通过NaOH溶液,干燥 |
| A、A | B、B | C、C | D、D |


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
 甲为初中化学常见物质,请根据下列叙述回答问题.
甲为初中化学常见物质,请根据下列叙述回答问题.| 甲 | 乙 | y轴含义 | |
| A | 生石灰 | 水 | 固体质量 |
| B | 铜锌合金粉末 | 硫酸铜溶液 | 溶液质量 |
| C | 工业炼铁的尾气 | 氢氧化钠溶液 | 气体质量 |
| D | 密闭容器中的空气 | 红磷 | 反应过程中容器内压强 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、铁丝在氧气中燃烧,火星四射 |
| B、红磷在空气中燃烧,产生大量白烟 |
| C、镁与稀盐酸反应产生气体,放出热量 |
| D、木炭在氧气中燃烧,发出白光,有黑色固体生成 |
查看答案和解析>>
科目:初中化学 来源: 题型:
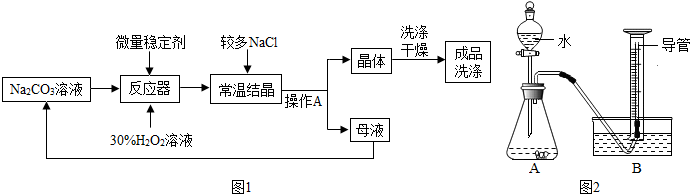
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
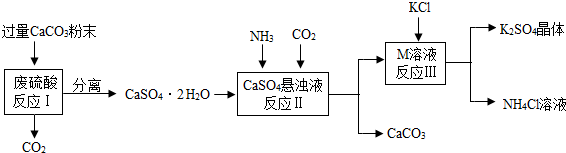
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(常温) | 34.0 | 11.1 | 37.2 | 19.5 |
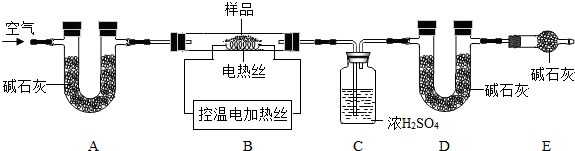
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com