
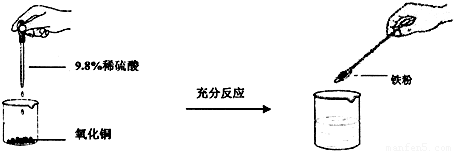
| 学生甲 | 学生乙 | 学生丙 | |
| 氧化铜的质量(g) | 8 | 8 | 8 |
| 9.8%稀硫酸的质量(g) | 50 | 100 | 150 |
| 铁粉的质量(g) | 5.6 | 5.6 | 5.6 |
| 加入铁粉后的现象 | 有红色和黑色固体 | 有红色固体 | 有红色固体 |


科目:初中化学 来源: 题型:阅读理解
| 金属 | Cr | Al | Cu |
| 与盐酸反应现 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?济宁)我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:
(2012?济宁)我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 观察到的现象 | 实验结论 |
将铁丝放入硫酸铜溶液中 将铁丝放入硫酸铜溶液中 |
铁丝表面有红色固体沉积 铁丝表面有红色固体沉积 |
金属铁的活动性比铜强 金属铁的活动性比铜强 |
将铜丝放入硝酸银溶液中 将铜丝放入硝酸银溶液中 |
铜丝表面有银白色固体沉积 铜丝表面有银白色固体沉积 |
金属铜的活动性比银强 金属铜的活动性比银强 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属 | Cr | Al | Cu |
| 与盐酸反应现 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属 | Cr | Al | Cu |
| 与盐酸反应现象 | 气泡产生缓慢,金 属逐渐溶解 |
气泡产生激烈,金 属迅速溶解 |
无气泡产生,金属 无变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com