【答案】
分析:(1)根据氢氧化锂和二氧化碳反应的化学方程式和二氧化碳的质量,就可计算出吸收11g二氧化碳需要氢氧化锂的质量;
(2)利用氢氧化钾与二氧化碳反应的化学方程式和二氧化碳的质量,就可计算出吸收11g二氧化碳需要氢氧化钾的质量;
(3)把(1)和(2)的计算结果比较,即可判断是用氢氧化锂还是用氢氧化钾来吸收二氧化碳;
(4)根据4位宇航员7天中放出二氧化碳的总质量,再利用化学反应方程式算出氢氧化锂的质量.
解答:解:(1)设吸收11g二氧化碳需要氢氧化锂的质量为X,
2LiOH+CO
2=Li
2CO
3+H2O
48 44
X 11g
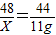
X=12g
答:设吸收11g二氧化碳需要氢氧化锂的质量为12g.
(2)设吸收11g二氧化碳需要氢氧化钾的质量为Y,
2KOH+CO
2=K
2CO
3+H
2O
112 44
Y 11g
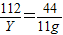
Y=28g
答:吸收11g二氧化碳需要氢氧化钾的质量为28g.
(3)因为12g<28g,所以用氢氧化锂吸收二氧化碳好.因为相同质量的氢氧化锂吸收的二氧化碳更多;
(4)解:4位宇航员7天共呼出CO
2的质量:502L×4×7×1.833g/L=25764.648g
设需带LiOH的质量为z.
2LiOH+CO
2═Li
2CO
3+H
2O
48 44
z 25764.648g
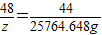
z=28106.9g
答:需带LiOH 的质量为28106.9g.
故答案为:(1)12;(2)28;(3)等质量的LiOH吸收CO
2质量比KOH的多,这样可以减轻宇宙飞船的自重;(4)28106.9g.
点评:本题主要考查学生运用化学方程式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

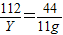
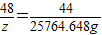


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案