


科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 |
| ① | 金属材料部分溶解,同时产生无色无味的气体. | |
| ②倒出实验①的溶液,再向剩余的金属固体中加入足量的盐酸,然后在加入足量氢氧化钠溶液 | 金属固体剩余物是镁 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 下列是初三某合作学习小组实验室制取二氧化碳气体
下列是初三某合作学习小组实验室制取二氧化碳气体| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大, 不与空气发生反应 不与空气发生反应 . |
| 收集过程分析 | 集满现象: 集气瓶口有气泡冒出 集气瓶口有气泡冒出 . |
“验满”分析:因气体无色,故集满与否较难确定.即便用燃着木条移近容器口火焰熄灭,也难以证明空气完全排尽. |
| 向收集到的CO2集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短. | 先浑浊后变澄清所需时间较长. |
| 由上述实验可得结论 | ① 二氧化碳可用排水法或向上排空气法收集; 二氧化碳可用排水法或向上排空气法收集; ;②用排水法收集到的二氧化碳比较纯净 用排水法收集到的二氧化碳比较纯净 . | |
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积(mL) | 35 | 47 | 55 | 51 | 42 |
| 试管编号 | A | B | C | D | E |
| 温度(℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和 比较 |
有少量气泡 | 气泡比A号试管多 | 气泡明显比B号试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:
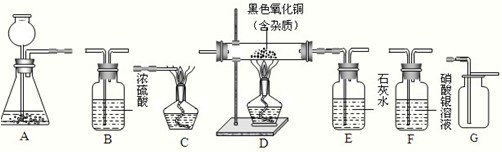
查看答案和解析>>
科目:初中化学 来源:2004年江苏省扬州市中考化学模拟试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com