
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 金属材料与人类的生产和生活密切相关.请回答:
金属材料与人类的生产和生活密切相关.请回答:查看答案和解析>>
科目: 来源: 题型:解答题
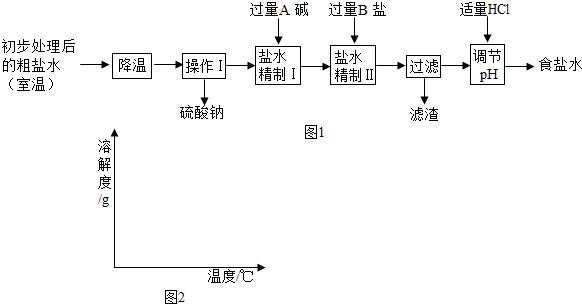
| 实验操作 | 实验现象 | 实验结论 |
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
查看答案和解析>>
科目: 来源: 题型:解答题
 如图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示填空:
如图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示填空:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 实验步骤 | 实验现象 | 实验结论 |
| 取C实验后的溶液少许,再向其加入 稀盐酸(或氯化钙溶液) | 有气泡产生(或有白色沉淀生成) | 验证了二氧化碳和氢氧化钠溶液反应. |
查看答案和解析>>
科目: 来源: 题型:解答题
 厨房中有一包无标识的白色粉末,经初步认定可能是氯化钠、碳酸钠、碳酸氢钠中的一种,小明对白色粉末的成分进行了探究.
厨房中有一包无标识的白色粉末,经初步认定可能是氯化钠、碳酸钠、碳酸氢钠中的一种,小明对白色粉末的成分进行了探究.| 实验步骤 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取少量溶液,滴加无色酚酞溶液 | 溶液变红色 | 白色粉末肯定不是氯化钠 |
| 2 | 取少量溶液,滴加稀盐酸 | 产生气泡 | / |
| 3 | 取少量溶液,滴加澄清石灰水 | 产生白色沉淀 | / |
查看答案和解析>>
科目: 来源: 题型:解答题
 某化学兴趣下组对金属的性质做了如下探究,请你填写空格:
某化学兴趣下组对金属的性质做了如下探究,请你填写空格:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com