
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用水壶烧水时,壶盖被顶开,说明水分子的体积在受热时变大了 | |
| B. | 水可以结成冰,说明水分子的化学性质发生改变 | |
| C. | 电解水生成氢气与氧气,说明水分子可以再分解 | |
| D. | 发生化学反应时,构成水分子的原子种类发生改变 |
查看答案和解析>>
科目: 来源: 题型:填空题
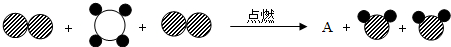
 ”表示碳原子,“
”表示碳原子,“ ”表示氢原子,“
”表示氢原子,“ ”表示氧原子,该生成物A为
”表示氧原子,该生成物A为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com