
科目: 来源:2020年5月江苏苏州市苏州新区中考模拟化学试卷 题型:填空题
“砂锅鱼头”汤鲜汁浓,其烹饪方法为:将鱼头下油锅煎黄后,放入砂锅中加适量食盐、葱段、生姜、香菜、矿泉水等,在火上煨煮数小时即成。
(1)鱼头中的蛋白质进入人体后会逐步分解成被人体吸收的_____。
(2)“砂锅鱼头”中几乎不含有的营养素是_____(填序号)。
A无机盐 B油脂 C糖类 D水
(3)鱼肉中富含铁、钙、磷等多种元素,青少年摄入_____元素可预防佝偻病和发育不良。
(4)液化气灶主要成分是丙烷(C3H8),煨制鱼头的砂锅外壁常因丙烷的_____(填“完全”或“不完全”)燃烧产生黑灰,将灶具的进风口_____(填“调大”或“调小”)可以避免黑灰产生。
(5)用洗洁精清洗油腻的砂锅是利用洗洁精的_____作用。
(6)新型冠状病毒蔓延期间,外山买鱼需佩戴符合要求的口罩。佩戴口罩预防病毒的原理相当于化学实验中的_____操作。活性炭口罩能有效阻隔空气中的氨、苯、甲醛等有害气体,其功能比普通罩强大,因为活性炭具有_____性。
查看答案和解析>>
科目: 来源:2020年5月江苏苏州市苏州新区中考模拟化学试卷 题型:填空题
波尔多液是农业上常用的杀菌剂,配制波尔多液的主要原料有生石灰和硫酸铜,在配制和使用时有诸多注意事项。
(1)配制时:先将生石灰、硫酸铜分别溶于水,该过程发生反应的化学方程式是_____,然后将所得的硫酸铜溶液缓慢倒入石灰乳中,即得到波尔多液,若将石灰乳倒入硫酸铜溶液中,易产生蓝色沉淀,该沉淀的化学式是_____。
(2)波尔多液中硫酸铜比例过高易造成药害,有经验的果农常将磨光的铁制芽接刀浸泡在药液里,若产生药害,只需1-2分钟就有明显现象出现,该现象是_____,反应的化学方程式是_____。
(3)铁制芽接刀与_____(填物质名称)接触易生锈,防锈方法有_____(填一种)。
查看答案和解析>>
科目: 来源:2020年5月江苏苏州市苏州新区中考模拟化学试卷 题型:科普阅读题
阅读下面的科普材料。
2019年度诺贝尔化学奖被授予约翰·古迪纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰其在锂离子电池的发展方面作出的贡献,奠定了无线电子产品的基础,给予我们进入无化石燃料世界的可能性,因为它能用于各种事物,从给电动汽车供电到从可再生能源中储存能量。
新能源汽车按照电池种类的不同可以分为镍氢电池动力汽车、锂电池动力汽车和燃料电池动力汽车。镍氢电池具有大功率、快速充放电等优点,但也有成本高,自放电程度大等不足,锂电池在整个充放电过程中,锂离子往返于正负极之间实现能量的转化。锂电池月自放电率仅为6%~8%,远低于镍氢电池。由于正极材料LiCoO2的价格高,目前是市场上高端电动汽车的主要动力源。质子交换膜燃料电池是燃料电池中的一种,其工作原理是在催化剂的作用下,氢气、氧气分别在各自电极发生电离后生成水,并释放出能量。由于质子交换膜燃料电池以铂族贵金属作电催化剂,燃料净化程度要求高,并且只能用热水回收余热,所以并未广泛应用。

(1)化石燃料是_____能源(填“可再生”或“非可再生”)。
(2)质子交换膜燃料电池可实现零排放,该反应的化学方程式是_____,能量转化形式为_____
(3)现有一种锂离子二次电池,其工作原理如图。放电时生成的Li2CO3固体和碳储存于碳纳米管中。放电时,电池的总反应为_____。
(4)下列说法中正确的是_____
A镍氢电池汽车具有大功率、快速充放电等优点
B锂电池月自放电率高,远高于镍氢电池
C电池属于无害垃圾,可以随意丟弃
D质子交换膜燃料电池电源是一种清洁的绿色环保电源
查看答案和解析>>
科目: 来源:2020年5月江苏苏州市苏州新区中考模拟化学试卷 题型:填空题
类价二维图反映的是元素的化合价与物质类别之间的关系,构建类价二维图是化学学习的重要方法。图1是某同学绘制的关于硫元素的类价二维图。

(1)图1中a物质的化学式为_____;b处对应物质的类别是_____。
(2)类价二维图中的物质在一定条件下可以相互转化。煤炭中的硫元素一定条件下会转化为硫化氢和二氧化硫,两种气体混合发生反应,微观示意图如图2所示,丁物质的化学式为_____。
(3)二氧化硫在空气中可以通过下列转化形成硫酸型酸雨:①2SO2+O2 2SO3;②_____,酸雨会导致土壤酸化,可以利用_____改良酸性土壤。
2SO3;②_____,酸雨会导致土壤酸化,可以利用_____改良酸性土壤。
(4)实验室利用硫酸铵和消石灰加热来制取氨气,该反应的化学方程式为:_____。
查看答案和解析>>
科目: 来源:2020年5月江苏苏州市苏州新区中考模拟化学试卷 题型:实验题
根据如图所给的仪器,回答问题。

(1)装配高锰酸钾制氧气的发生装置需要用到的仪器有_____(填字母)。写出该反应化学方程式_____。某同学进行该实验并用排水法收集氧气。下列操作正确的是_____(填字母)。
a、未检查装置气密性即向大试管中加入高锰酸钾固体
b、当导管口有连续气泡均匀冒出时,开始收集氧气
c、集气瓶中氧气收集满后,先用玻璃片盖住集气瓶口,再将其移出水面
d、气体收集完毕后,先熄灭酒精灯,再将导管移出水面
(2)某同学用大理石和稀盐酸制取二氧化碳,为了检验并收集到干燥的二氧化碳气体,在发生装置后依此连接装有足量_____、_____的甲装置,再连接乙装置的_____端(填“a”或“b”)进行收集。将收集的二氧化碳气体倒入如图装置,能观察到_____的现象,这是由于二氧化碳具有_____的性质。

查看答案和解析>>
科目: 来源:2020年5月江苏苏州市苏州新区中考模拟化学试卷 题型:流程题
氯化钙应用广泛,以石灰石(杂质主要是Fe2O3、MgSO4)为原料生产CaCl2,的流程如下:

(1)氧化铁和盐酸反应的化学方程式为_____
(2)滤液1中的溶质有HCl、FeCl3、MgSO4和_____
(3)写出滤液1中加入BaCl2发生的化学反应方程式:_____
(4)滤液2中加入Ca(OH)2可以除去HCl、MgCl2和_____
(5)滤液3呈碱性,为使溶液pH降低,可加入适量的_____
查看答案和解析>>
科目: 来源:2020年5月江苏苏州市苏州新区中考模拟化学试卷 题型:科学探究题
某校化学兴趣小组同学利用数字化仪器对镁与盐酸反应进行研究。
(查阅资料)
①饱和氯化镁溶液的pH约为4;②氢氧化镁加热到350℃失去水生成氧化镁。
(实验过程)
(1)实验前先将镁条需先打磨的原因是_____
(2)将打磨后的镁条放入锥形瓶中,再将注射器中某浓度的盐酸压入锥形瓶中,通过数字传感器测定实验中密闭容器(气密性良好)内压强与时间的关系如图所示。
(3)用pH试纸测定反应后溶液的酸碱度。

(结果分析)
①将注射器刚注入盐酸时镁条表面无明显气泡,但此时压强上升迅速,原因可能是_____。
②镁条与盐酸反应的化学方程式为_____。图中a、b、c、d四个点中,产生氢气最快的为_____点。
③图中c点镁条已完全溶解,cd段容器内压强逐渐减小的原因可能是_____。
④测定反应后的溶液pH的操作为_____(填对应选项的字母)。
A将pH试纸直接插入溶液中,并将试纸显示的颜色与标准比色卡比较,读出pH
B将pH试纸放在玻璃片上,用干净的玻璃棒蘸取溶液滴在pH试纸上,并将试纸显示的颜色与标准比色卡比较,读出pH
C将湿润的pH试纸放在玻璃片上,用干净的玻璃棒蘸取溶液滴在pH试纸上,并将试纸显示的颜色与标准比色卡比较,读出pH
⑤同学们根据测得反应后溶液的pH就直接得出其中含HCl,该pH的值可能是下列选项中的_____(填对应选项的字母)。
А 3В 5С 6
⑥甲同学提出向反应后的溶液中逐滴滴加NaOH溶液并振荡,若观察到_____的现象,也可以确定溶液中含HCl。
(拓展研究)
取少量镁条与过量盐酸反应后的溶液蒸干并灼烧,向灼烧所得固体中投入少量水,未见固体完全溶解,向其中滴加酚酞试液变为红色。灼烧所得固体的成分可能为_____。
查看答案和解析>>
科目: 来源:2020年5月江苏苏州市苏州新区中考模拟化学试卷 题型:实验题
抗击“新型冠状病毒”用到的过氧乙酸(C2H4O3)是一种高效消毒剂。可由冰醋酸(C2H4O2)和双氧水在浓硫酸催化作用下制得,实验装置和步骤如下:
步骤1:在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;步骤2:不断搅拌并控制三颈烧瓶中混合液的温度为20~30℃至反应结束,在锥形瓶中收集产品。
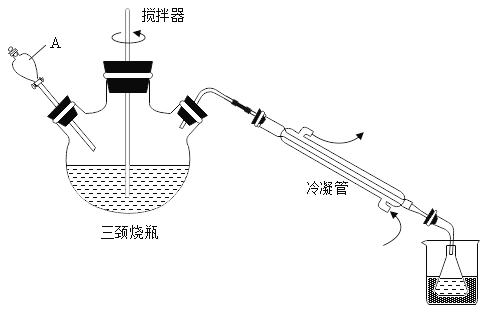
(1)仪器A的名称是_____
(2)步骤2搅拌的目的是_____
(3)下列关于过氧乙酸和冰酷酸的说法正确的是_____
a、过氧乙酸属于氧化物
b、过氧乙酸的相对分子质量为76
c、冰醋酸中C、H、O元素的质量比为6:1:8
d、过氧乙酸中氧元素的质量分数小于冰醋酸中氧元素的质量分数
(4)实验测得生成物过氧乙酸的质量分数随反应物比例 和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例是_____;最佳反应时间约_____。
和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例是_____;最佳反应时间约_____。
反应物比例 | 反应时间 | |||||
0.5h | 1h | 3h | 5h | 7h | ||
2:1 | 7.38% | 8.46% | 9.42% | 11.26% | 13.48% | |
1:1 | 10.56% | 12.92% | 13.54% | 20.72% | 20.80% | |
1:2 | 6.14% | 7.10% | 7.96% | 10.38% | 12.36% |
(5)产品中过氧乙酸的质量分数的测定方法如下:取5.00g过氧乙酸产品,加水稀释成100g溶液;从中取出5.00g溶液,先除去残余的H2O2,再加入稍过量的KI溶液,充分发生反应:C2H4O3+2KI+H2SO4=K2SO4+I2+C2H4O2+H2O,反应结束后,经实验测得生成I2的质量为0.127g,试计算原产品中过氧乙酸的质量分数。_____(写出计算过程,结果保留1位小数)。
(6)请根据你学过的“一定溶质质量分数溶液的配制”方法配制0.5%的过氧乙酸,用于地面、墙壁、门窗的消毒。
(实验用品)溶质质量分数为20%的过氧乙酸(密度为1.0261g/cm3)、水、1000mL量筒、10L塑料桶、木棒、口罩、眼镜、橡皮手套。
(实验步骤)①计算:将200mL20%的过氧乙酸(密度为1.026g/cm3)稀释为0.5%的过氧乙酸,需加入水的体积为_____mL(计算结果保留一位小数);
②配制:用量筒量取200mL20%的过氧乙酸倒入塑料桶中,按比例兑水,用木棒搅拌后,盖好桶盖待用。
(实验反思)
①由于过氧乙酸有腐蚀性,因此在配制溶液时要注意_____;
②在配制过氧乙酸过程中不能用铁器皿,原因是_____。
查看答案和解析>>
科目: 来源:黑龙江省牡丹江市2019-2020学年九年级下学期线上期中化学试卷 题型:单选题
下列变化中,属于化学变化的是( )
A.酒精挥发 B.氢氧化钠固体潮解
C.海水晒盐 D.火药爆炸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com