
科目: 来源: 题型:
【题目】根据下列仪器或装置回答:

(1)写出仪器a的名称:________。
(2)实验室如果用过氧化氢溶液来制取较纯净的氧气,则应选用的发生装置和收集装置为______,(填字母)发生反应的化学方程式为___________________,
(3)实验室制取CO2的反应方程式为____________________________;
(4)若要收集并测定CO2气体的体积,应选择下图中的________装置(填“甲”或“乙”),广口瓶中液体上方的空气对测定结果________(填“有”或“无”)影响。

查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳生活,绿色出行”。下图为淮南公共自行车。请回答下列问题:

(1)图中所标示的各部件中,属于金属材料的是________(填写序号,下同),属于有机合成材料的是_____。
(2)公共自行车的闸线为钢丝,说明金属具有________性。
(3)车架表面喷漆不仅美观,而且可有效防止与____接触而生锈。防止公共自行车链条生锈的有效措施是___。
(4)公共自行车有些零件选用了铝合金材料,其优点是质量轻、硬度大和________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是( )

A. 甲的溶解度大于乙的溶解度
B. 降低温度可使接近饱和的甲溶液变成饱和溶液
C. 35℃时100g甲的溶液中含甲物质的质量为60g
D. 10℃时甲、乙两种溶液的溶质质量分数一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】2014年以来,西非的一些国家暴发埃博拉病毒,致使几千人丧命。中药葛根是治疗埃博拉病毒的有效成分之一,葛根的主要成分是葛根素,它的化学式是C21H20O9,下列有关葛根素的说法正确的是( )
A. 葛根素由21个碳原子、20个氢原子和9个氧原子构成的
B. 葛根素中碳、氢、氧元素质量比是21︰20︰9
C. 葛根素的相对分子质量是416
D. 葛根素中氧元素的质量分数最大
查看答案和解析>>
科目: 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量.溶液电导率大小变化可以反映电解质溶液中离子浓度的大小变化。下图是向100mL一定溶质质量分数的Ba(OH)2溶液中分别滴加稀H2SO4溶液和稀Na2SO4溶液的过程中溶液电导率随时间变化图。回答下列问题。

(1)写出Ba(OH)2与H2SO4反应的化学方程式_______________。
(2)若在图中A-E各点对应的溶液中滴加酚酞,则溶液呈红色的有____________。
(3) D-→E的反应过程中,溶液中数目始终增多的微粒有___________。
(4)经测定,B点时消耗稀H2SO4溶液50mL,且过滤后滤液质量为147. 67g。请计算原Ba(OH)2溶液的溶质质量分数__________(写出计算过程,各种稀溶液的密度都可看成1g·mL-1)。
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、 CuSO4及H2SO4,如图所示实验可制取补血剂原料碳酸亚铁并回收铜。

(1)步骤Ⅰ中,发生反应的化学方程式包括:
①Fe2(SO4)3+Fe =3FeSO4,②_________________,③_____________________。
(2)步骤Ⅱ中加入一种试剂可实现其转化,该试剂可以是_____________(填化学式)。
(3)步骤Ⅲ回收铜的实验操作包括:①过滤,②洗涤,③加足量稀硫酸,④干燥。正确的操作排序是___________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组在老师指导下制取、干燥、收集氨气,并探究氨气的一些性质。
资料卡片:氨气通常情况下是有刺激性气味的无色气体,密度比空气小,极易溶于水,易液化,液氨可作制冷剂。 加热熟石灰和氯化铵固体混合物的方法可以发生复分解反应生成氨气。如要快速产生氨气,可以将浓氨水滴加到生石灰中得到。

(1)利用A装置制取氨气的化学方程式为_______________。将浓氨水滴加到生石灰中快速产生氨气,发生装置最好选用________(选填装置编号)。
(2)干燥氨气可以将气体通过装有_____(填化学式)的装置D。
(3)兴趣小组计划用E装置收氨气,简述判断氨气已经集满的方法____________。
(4)按下图连接仪器后,计划在纯净水塑料瓶内引发“喷泉”,你会采取的操作是__________。

(5)试验后为处理纯净水塑料瓶内存在的氨水(NH3·H2O)可以加入少量稀硫酸,发生反应的化学方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以饱和NaCl溶液、饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+ NH4HCO3=NaHCO3↓+NH4HCl(已知: NH4HCO3在40℃时受热易分解)回答下列问题。
(1)该反应中的四种物质溶解度曲线如图所示。
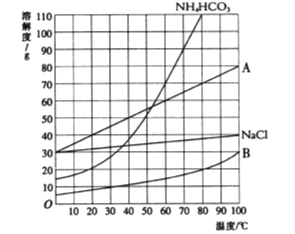
①35℃时,比较A、B溶解度的大小:A_________(填“<”或“>”)B。
②图中表示NaHCO3溶解度曲线的是_________(填“A”或“B”)。
(2)为探究NaHCO3析出的最佳条件,某化学兴趣小组完成了下表中的几组实验:
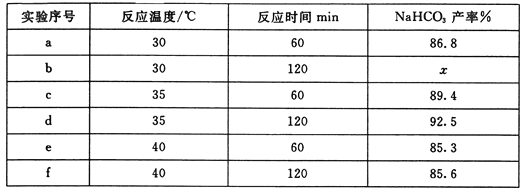
①实验c和d的目的是____________________。
②表格中 的数值可能为_______(填字母)。
A. 85.8 B. 86.8 C. 92.1 D. 93.1
③在相同反应时间内,40℃时NaHCO3的产率比35℃时低的原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列实验。
(1)用浓盐酸(溶质质量分数为37%,密度为1. 18g·mL-1)配制200g 10%稀盐酸。
①配制的主要步骤为:计算、_________、溶解。
②设豁浓盐酸的体积为V,请列出V的计算式_____________________(不必算出结果)。
(2)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
![]()
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和_______________。
②在蒸发过程中,待___________时,停止加热,利用余热将滤液蒸干。
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列反应的化学方程式.
(1)锌和稀硫酸反应__________________________________。
(2)含氢氧化铝的药物治疗胃酸过多症_____________________。
(3)生锈的铁器用稀盐酸“酸洗”______________________。
(4)工业上通过电解饱和食盐水得到氢氧化钠、氯气和氢气________________。
(5)放置在空气中的装有澄清石灰水试剂瓶口白色固体的形成_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com