
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=+725.76 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 | |
| C. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1 451.52 kJ•mol-1 | |
| D. | 2H2+O2═2H2O△H=-285.8 kJ/mol |
分析 实验测得:101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量,则氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1;1mol CH3OH(l)完全燃烧生成液态水和CO2,放出725.76kJ的热量,则甲醇燃烧的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1,据此进行解答.
解答 解:A.甲醇的燃烧为放热反应,焓变值有关小于0,正确的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1,故A错误;
B.101kPa时,H2的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1,故B正确;
C.2mol甲醇燃烧生成液态水水放出的热量为1451.52 kJ,该热化学方程式中水的状态不合理,故C错误;
D.热化学方程式中必须注明物质的状态,故D错误;
故选B.
点评 本题考查了热化学方程式的书写方法,题目难度不大,明确热化学方程式的书写原则为解答关键,注意掌握燃烧热的概念及含义,试题培养了学生的灵活应用能力.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有金属化合物才有焰色反应 | |
| B. | 只有某些金属或其化合物才有焰色反应 | |
| C. | 透过蓝色钴玻璃观察钾元素焰色反应的颜色为紫色 | |
| D. | 每次焰色反应实验后都要将铂丝蘸取盐酸洗涤并灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极,电极反应式:2H++2e-═H2↑ | |
| C. | 电解质溶液中,SO42-向正极方向移动 | |
| D. | 外电路电子流入的一极为正极,电子流出的一极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
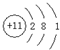 .C、D、E的简单离子半径由小到大的顺序Al3+<Na+<O2-( 用离子符号表示).
.C、D、E的简单离子半径由小到大的顺序Al3+<Na+<O2-( 用离子符号表示).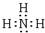 .检验该气体的常用方法是用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在.
.检验该气体的常用方法是用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2溶于水:3NO2+H2O=2H++2NO3-+NO↑ | |
| B. | 用氨水吸收过量的SO2气体:2OH-+SO2=SO32-+H2O | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA | |
| B. | 0.05 mol熔融的NaHSO4中含有的阳离子数为0.10NA | |
| C. | 11.2 L乙烯、乙炔的混合气体中含有的碳原子数为NA | |
| D. | 5.6 g Fe和足量盐酸完全反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属原子间以共价键结合形成的物质都是共价化合物 | |
| B. | Na2CO3和CaCl2中化学键类型(离子键、共价键)完全相同 | |
| C. | 阴、阳离子通过静电引力而形成的化学键叫做离子键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com