
分析 (1)①反应中铁元素由+2价升高到+6价,过氧化钠中的部分氧由-1价升高到0价,根据氧化还原反应中元素化合价升降规律,过氧化钠中的另一部分氧一定会由-1价降低到-2价,反应中硫、铁原子已经守恒,故X只能为Na2O;根据原子守恒判断a、c关系;
②利用氧化性消毒,利用胶体吸附杂质;
(2)①高铁酸钾是生成物,则Fe(OH)3是反应物,该反应中Fe元素化合价由+3价变为+6价,则Fe(OH)3是还原剂,还需要氧化剂参加反应,C1O-具有强氧化性,所以C1O-是反应物,生成物是C1-,Cl元素化合价由+1价变为-1价,转移电子数为6;
②该反应中Fe元素化合价由+3价升高到+6价,Cl元素化合价由+1价变为-1价,转移电子数为6,根据转移电子和高铁酸根离子之间关系式计算转移电子物质的量、根据转移电子和还原产物之间关系式计算还原产物物质的量;
③相同条件下溶解度低的先析出.
解答 解:(1)①反应中铁元素由+2价升高到+6价,过氧化钠中的部分氧由-1价升高到0价,根据氧化还原反应中元素化合价升降规律,过氧化钠中的另一部分氧一定会由-1价降低到-2价,反应中硫、铁原子已经守恒,故X只能为Na2O,配平后方程式为2FeSO4+6Na2O2 $\frac{\underline{\;高温\;}}{\;}$2Na2FeO4+2Na2O+2Na2SO4+O2↑,可知a=4+2c,
故答案为:Na2O;a=4+2c;
②K2FeO4具有强氧化性,能杀菌消毒,消毒过程中自身被还原为铁离子,铁离子水解生成胶体可吸附水中悬浮杂质而沉降,从而净化水,
故答案为:K2FeO4具有强氧化性,能杀菌消毒,消毒过程中自身被还原为铁离子,铁离子水解生成胶体可吸附水中悬浮杂质而沉降;
(2)①高铁酸钾是生成物,则Fe(OH)3是反应物,该反应中Fe元素化合价由+3价变为+6价,则Fe(OH)3是还原剂,还需要氧化剂参加反应,C1O-具有强氧化性,所以C1O-是反应物,生成物是C1-,Cl元素化合价由+1价变为-1价,转移电子数为6,溶液在碱性条件下进行,则氢氧化根离子参加反应,生成水,反应方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O中Fe元素化合价由+3价升高到+6价,则该反应中转移电子数为6,每生成1mol FeO42-转移电子物质的量$\frac{6mol}{2}$=3mol,该反应中还原产物是氯离子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量$\frac{0.3mol}{6}$=0.15mol,
故答案为:3;0.15;
③由于该温度下K2FeO4比Na2FeO4的溶解度小,所以低温下在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),故答案为:该温度下K2FeO4比Na2FeO4的溶解度小.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查学生分析计算能力,正确判断各个物理量之间关系式是解本题关键,难点是化学反应方程式的配平,要注意原子守恒、转移电子守恒及电荷守恒,题目难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:填空题
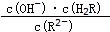 将减小(填“增大”或“减小”或“不变”或“无法判断”)
将减小(填“增大”或“减小”或“不变”或“无法判断”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收少量SO2气体:NH3•H2O+SO2→NH4++HSO3- | |
| B. | FeI2溶液中通入Cl2至Fe2+恰好完全被氧化:2Fe2++Cl2→2Fe3++2Cl- | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-→CO32-+H2O | |
| D. | 在Ca(ClO)2溶液中通入足量的CO2气体:ClO-+CO2+H2O→HClO+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 | |
| C. | 分别用蒸馏水稀释m倍和n倍,若两溶液pH仍相同,则m>n | |
| D. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [A-]>[B+]>[H+]>[OH-] | B. | [B+]>[A-]>[H+]>[OH-] | C. | [B+]>[A-]>[OH-]=[H+] | D. | [A-]>[B+]>[OH-]>[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
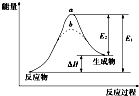
| A. | 逆反应的活化能小于正反应的活化能 | |
| B. | a、b分别对应有催化剂和无催化剂的能量变化 | |
| C. | 该反应的反应热△H=E2-E1 | |
| D. | 催化剂能改变反应的焓变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com