
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 |
起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
| 3.4+3.3+3.5 |
| 3 |
| 1.4212kJ |
| 0.025mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、实验Ⅰ:配置一定物质的量浓度的溶液 |
| B、实验Ⅱ:除去Cl2中的HCl |
| C、实验Ⅲ:用水吸收NH3 |
| D、实验Ⅳ:石油的分馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=-4b kJ?mol-1 |
| B、已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ?mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量数值小于270 kJ |
| C、常温常压下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ?mol-1 |
| D、已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ?mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ?mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 6 |
| 顺序 | 步骤 | 实验现象 |
| 1 | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
| 2 | 滴入淀粉KI溶液,振荡 | 溶液无变化 |
| 3 | 然后再滴加稀H2SO4,振荡. | 溶液变蓝色 |
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.
下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.查看答案和解析>>
科目:高中化学 来源: 题型:
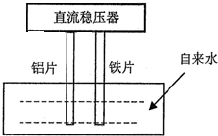 一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )
一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )| A、通电时,铝片做阳极,铁片做阴极 |
| B、生成的气泡、红棕色或灰绿色的沉淀都是电解的直接产物 |
| C、通过对比,确实能说明自来水中含有大量对人体有毒有害的物质 |
| D、铝片的电极反应:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2++2OH-→Mg(OH)2↓ |
| B、Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O |
| C、Mg2++HCO3-+Ca2++3OH-→Mg(OH)2↓+CaCO3↓+H2O |
| D、Mg2++4HCO3-+2Ca2++4OH-→2MgCO3↓+2CaCO3↓+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 铁的质量/g | 铁的形态 | c(H2SO4) /mol?L-1 |
V(H2SO4) /mL |
溶液温度 | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 铁片 | 0.7 | 50 | 20 | 36 | 250 |
| 2 | 0.10 | 铁片 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 铁粉 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 铁片 | 1.0 | 50 | 20 | 35 | 125 |
| 5 | 0.10 | 铁片 | 1.0 | 50 | 35 | 50 | 20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com