



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5a≤b≤0.75a |
| B、16a≤b≤24a |
| C、0.2a≤b≤0.3a |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为:2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示.则下列有关说法错误的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为:2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示.则下列有关说法错误的是( )| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B、图中BC段发生的反应为2Fe3++2I-→2Fe2++I2 |
| C、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol |
| D、根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验方案 | 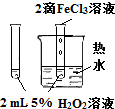 |
 将NO2球浸泡在冰水和热水中 |
 |
 |
| 实验 目的 |
验证FeCl3对H2O2分解反应有催化作用 | 探究温度对平衡 2NO2?N2O4的影响 |
除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 依据某氧化还原反应设计的原电池如图所示.
依据某氧化还原反应设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com