
 氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
| 容器 | c(CO2) /mol•L-1 | c(H2) /mol•L-1 | c(CH3OCH3) /mol•L-1 | c(H2O) /mol•L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
分析 (1)由于所给的①和②中存在氢气的燃烧,缺少氢气燃烧的数据;
(2)a和b比较是反应物的浓度增加一倍,据此可以计算b放出的能量E,由于温度不变,可以计算b状态的平衡常数;
(3)反应物浓度越大,反应速率越大;t1时刻后,化学反应达到平衡,据此判断;温度升高,化学反应速率加快,达到平衡时间变短,且平衡左移,导致氨气的物质的量减小,据此解答即可;
(4)平衡状态的标志是:正逆反应速率相等,根据平衡常数表达式来计算平衡常数;根据任意态的浓度熵和平衡常数的关系来判断是否是平衡状态以及反应的移动方向.
解答 解:(1)由于没有给出氢气的燃烧热数据,故不能利用①和②表示△H,故答案为:无;不能,缺少氢气的燃烧热;
(2)b与a相比,是反应物的浓度增大一倍,
①由于b是增加的反应物的浓度,导致平衡右移,故反应a和反应b的氢气转化率不相同,故①错误;
②温度不变,平衡常数不变,可以依据数据23.1计算此时的平衡常数,b状态下平衡常数与a相等,故②正确;
③b中浓度是a的2倍,利用已知数据可以计算反应b放出的能量E,故③正确;
④由于b状态与a相比,浓度增大,平衡右移,故氨气体积不同,故④错误,
故选②③;
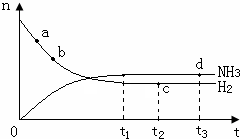
(3)由于a点反应物的物质的量最大,故a点化学反应速率最快,时刻,化学反应达到平衡状态,此时各种物质的物质的量不变,即c、d两点氮气的物质的量相同,温度升高,化学反应速率加快,达到平衡时间变短,且平衡左移,导致氨气的物质的量减小,此时图象为: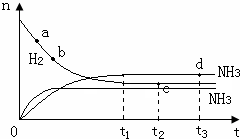 ,故答案为:a;cd;
,故答案为:a;cd;  ;
;
(4)设备I中正逆反应速率相等的状态是平衡状态,根据平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})×{c}^{3}({H}_{2}O)}{{c}^{2}{(C{O}_{2})×c}^{6}({H}_{2})}$=$\frac{(1×1{0}^{-4})^{4}}{(1×1{0}^{-2})^{8}}$=1,因为该反应的平衡常数K=1.0,而设备 II中Qc=c(CH3OCH3)•c3(H2O)/c2(CO2)•c6(H2)=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6=2.0,所以Qc>K,反应正在向逆反应方向进行,v(正)<v(逆),故答案为:因为该反应的平衡常数K=1.0,而设备 II中Qc=c(CH3OCH3)•c3(H2O)/c2(CO2)•c6(H2)=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6=2.0,所以Qc>K,反应正在向逆反应方向进行,v(正)<v(逆),
故答案为:是;1.0;v(正)<v(逆).
点评 本题主要考查的是盖斯定律的应用、化学反应速率与平衡以及其影响因素、平衡常数的计算等,本题综合性较强,难度较大.


科目:高中化学 来源: 题型:多选题
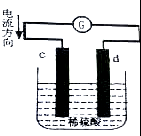 如图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c,d为两个电极.则下列有关的判断不正确的是( )
如图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c,d为两个电极.则下列有关的判断不正确的是( )| A. | d为负极,电池工作时,d极发生氧化反应 | |
| B. | c为锌片,电池工作时,溶液中SO42-向c极移动 | |
| C. | 电池工作的过程中,d电极上产生大量的气泡 | |
| D. | 电池工作的过程中,溶液的pH基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①③④⑤ | B. | ①②③④⑤ | C. | ②③①④⑤ | D. | ③②①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
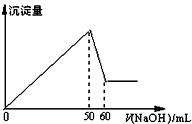 在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度
在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度| A. | 1:1 | B. | 3:1 | C. | 1:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 基态原子M层全充满,N层只有一个电子 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 非金属性强弱 | |
| A | CH4受热分解的温度比SiH4高 | C>Si |
| B | C与SiO2在高温下反应生成Si和CO | C>Si |
| C | 稀盐酸与Na2SiO3溶液反应生成H2SiO3胶体 | Cl>Si |
| D | H2SO3是中强酸,H2SiO3是弱酸 | S>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com