
| A. | 甲烷 | B. | 乙烯 | C. | 甲苯 | D. | SO2 |
科目:高中化学 来源: 题型:实验题
 某实验小组同学探究铜与硝酸的反应.
某实验小组同学探究铜与硝酸的反应.| 序号 | 浓硝酸与水的体积比 | 实验现象 |
| Ⅰ | 1:1 | 反应速率快,溶液很快变成蓝色,大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1:3 | 反应速率快,溶液变成蓝色,大量气泡冒出,气体呈无色 |
| Ⅲ | 1:5 | 反应速率慢,微热后加快,溶液变成蓝色,气泡冒出,气体无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅的分子式:SiO2 | |
| B. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| C. | 甲基的电子式: | |
| D. | 邻羟基苯甲酸的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④ | C. | ②⑤⑥ | D. | ①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑦ | B. | ②③④⑧⑨⑩ | C. | ①②⑤⑥⑦ | D. | ①⑤⑥⑦⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精是指质量分数为75%的乙醇溶液 | |
| B. | 用过滤的方法可以分离乙醇和乙酸乙酯 | |
| C. | 油脂、淀粉、纤维素、蛋白质都是高分子化合物 | |
| D. | 石油的裂解是使石油分馏产物中的长链烃断裂成乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
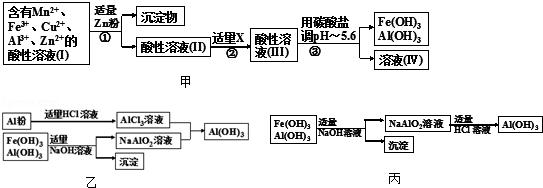
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 化合物A在一定条件下发生分解反应,反应物浓度随反应时间的变化如图所示.则化合物A在4~8min间的平均反应速率为( )
化合物A在一定条件下发生分解反应,反应物浓度随反应时间的变化如图所示.则化合物A在4~8min间的平均反应速率为( )| A. | 0.20 mol•L-1•min-1 | B. | 0.25 mol•L-1•min-1 | ||
| C. | 0.30 mol•L-1•min-1 | D. | 0.50 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com