
温度 溶解度 盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | ① | -- | -- | -- |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | -- |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ 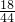 =
= X=0.18g
X=0.18g 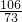 =
=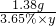 y=26.4g
y=26.4g  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ 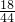 =
= X=0.18g
X=0.18g 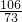 =
=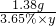 y=26.4g
y=26.4g 

 高中必刷题系列答案
高中必刷题系列答案科目:初中化学 来源: 题型:
温度 盐 溶解度 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
温度 溶解度 盐 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | ① | -- | -- | -- |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | -- |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| ||
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省溧阳市中考模拟化学试卷(解析版) 题型:计算题
根据侯德榜制碱法原理,实验室制备纯碱(Na2CO3)的主要步骤是::将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,经过处理后,转入蒸发皿中,灼烧2小时,得Na2CO3固体。
四种盐在不同温度下的溶解度(g)表
|
溶解度 盐 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
① |
—— |
—— |
—— |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
—— |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
 已知:1、①温度高于35℃NH4HCO3会分解。
已知:1、①温度高于35℃NH4HCO3会分解。
2、碳酸氢钠受热分解:2 NaHCO3= Na2CO3+H2O+CO2↑
(1)饱和NaCl溶液中加入NH4HCO3固体,发生了复分解反应,生成NaHCO3晶体,写出其中发生反应的化学方程式 。
(2)加料完毕后,继续保温30分钟,目的是 ,用蒸馏水洗涤NaHCO3晶体的目的是除去杂质,杂质中一定含有的物质是 (以化学式表示)。
(3)过滤掉NaHCO3晶体后的滤液中还有一定量的NaHCO3溶解在水中,此时可向滤液中加入一定量的 ,并作进一步处理,使NaCl溶液循环使用。
(4)某小苏打样品中混有少量碳酸钠,取药品2.0g加热到质量不再减少为止,共收集到二氧化碳气体0.22L(二氧化碳的密度为2.0g/L)。向加热后的剩余固体中加入一定量质量分数为3.65%的稀盐酸,使其恰好完全反应,求消耗该稀盐酸的质量是多少克?
查看答案和解析>>
科目:初中化学 来源:2006年江苏省淮安市开明中学化学竞赛训练试卷(解析版) 题型:解答题
温度 盐 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com