
【题目】如图为A、B两种固体物质的溶解度曲线.
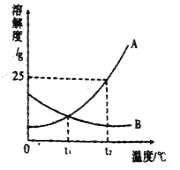
(1)在 ℃时,A、B两种物质的溶解度相等.
(2)t2℃时,100g水中溶解 gA物质恰好饱和,该饱和溶液中溶质的质量分数为 .若要把该饱和溶液稀释成质量分数为10%的溶液,应加水 g.
(3)t2℃时,分别将恰好饱和的A、B两种物质的溶液降温至t1℃,A,B两物质溶质的质量分数的大小关系是 .
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】下列实验操作符合操作规范的是
A.滴瓶上的滴管用完后立即用清水洗干净并放回滴瓶中
B.实验室加热高锰酸钾并用排水法制取氧气,结束时先熄灭酒精灯后从水中移出导管
C.实验室用剩的药品应放回原试剂瓶,避免浪费
D.过滤时,漏斗中的液面应低于滤纸的边缘
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明和小白都用下面的这套装置做实验,A中所加的药品不同,C中所加药品相同,B中都放一个燃着的蜡烛,敞口时蜡烛能持续燃烧。
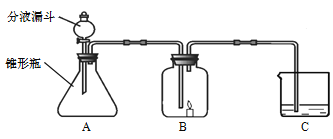
(1)小明在分液漏斗、锥形瓶和C中分别加了药品,并使之混合,再盖上B的塞子,连接成如图所示,发现B中的蜡烛熄灭,C中的溶液变浑浊,写出C中反应的化学方程式 。
(2)小白也在分液漏斗、锥形瓶和C中分别加了药品,并使之混合,再盖上B的塞子,连接成如图所示,发现B中的蜡烛燃烧的更旺,C中的溶液也变浑浊,写出A中发生反应的方程式 。小白说C中的现象证明蜡烛中含有碳元素,你认为小白说的对吗? 。请简述理由 。
(3)小白想进一步探讨C中白色浑浊物的成分,把C中的白色浑浊物从水溶液中分离出来了,她用的方法是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学研究在人类文明进程中,对生活质量的提高、社会的发展发挥着重大的作用.
① 研究物质成分
Ⅰ.高原缺氧中的“氧”指的是 (填“单质”、“元素”或“原子”).
Ⅱ.某盐进行焰色反应,火焰呈紫色,该盐中一定含有 .
② 研究新的物质产生
Ⅰ.炼铁的原理是用一氧化碳与铁矿石中的氧化铁反应,写出反应的化学方程式 ,反应中发生还原反应的物质是 .
Ⅱ.请配平制烧碱的化学方程式:
![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】燃料的合理使用是解决环境污染重要途径.
① 氢气被誉为“最理想的燃料”,请用化学方程式解释原因 .
② 近年各地雾霾频发导致呼吸系统疾病病人增多,是因为空气中新增了大量的 (填字母序号).
A.二氧化碳 B.氮氧化合物 C.二氧化硫 D.可吸入颗粒物
③ 我国已经开发和推广使用乙醇汽油,其中含乙醇(C2H5OH)10%,乙醇的摩尔质量是 , 每摩尔乙醇分子中含 个氢原子.
④ 乙醇和甲烷都是常用的燃料,完全燃烧后产物相同,若燃烧2mol乙醇释放出的二氧化碳与 g甲烷燃烧释放出的二氧化碳的质量相等.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的三个实验.
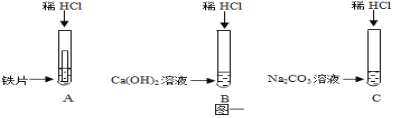
(1)写出A试管中的反应现象 ;
(2)写出B试管中反应的化学方程式 ;
(3)实验结束后,小组同学将B、C两支试管中的废液同时倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成.同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究.
【提出猜想】
甲同学猜想:NaCl; 乙同学猜想:NaCl、CaCl2;丙同学猜想:NaCl、CaCl2、HCl;
你的猜想: ;
【交流讨论】你认为 同学的猜想一定不正确,理由是 ;
【设计实验】请设计实验证明你的猜想正确.
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加 | 猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家发现,亚硒酸钠能消除加速人体衰老的活性氧。亚硒酸钠中硒元素(Se)为+4价,氧元素为-2价,则亚硒酸钠的化学式为
A.Na2SeO3 B.Na2SeO4 C.NaSeO3 D.Na2SeO2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放.
(1)镁元素在自然界中是以 (填“单质”或“化合物”)形式存在.
(2)工业制镁的一种原理是 2MgO+Si+2CaO![]() 2Mg↑+Ca2SiO4,抽走容器中的空气对反应有促进作用,且能防止空气中的物质与Mg反应使产品混有 (填化学式).
2Mg↑+Ca2SiO4,抽走容器中的空气对反应有促进作用,且能防止空气中的物质与Mg反应使产品混有 (填化学式).
(3)制镁的原料MgO可从海水中获得.小华利用镁与盐酸反应后的废液,模拟从海水中获取MgO的过程,实验如下:
步骤1:向上述废液中,边搅拌边分批加入CaO,至MgCl2完全沉淀为止,过滤得Mg(OH)2固体.共消耗8.4g CaO.
步骤2:将Mg(OH)2固体加热分解为MgO和水,所得MgO的质量为2.4g.
①步骤2中Mg(OH)2分解的化学方程式为 .
②通过所得MgO的质量计算上述废液中含MgCl2的质量m= g.
③分析实验数据,可知步骤Ⅰ中反生的化学反应有:
CaO+H2O═Ca(OH)2;Ca(OH)2+MgCl2═CaCl2+Mg(OH)2↓; .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com