
【题目】(一)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
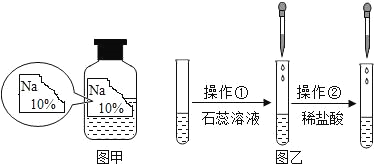
(猜想与假设)
其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
(资料查阅)上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
(探究过程)
如图乙所示,在操作①后可确定溶质不是NaCl,则实验过程和实验现象应是_____;在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的_____。
(探究结论)
你认为该溶液中的溶质可能是上述假设物质中的_____,你的判断依据是_____。
(探究反思)
(1)若上述探究结论是正确的,操作②产生的气体应是_____(写化学式),实验室检验该气体的实验操作及现象是_____。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由:_____。
(二)兴趣小组的同学在做镁条和盐酸反应实验时发现,试管外壁很烫,试管口出现白雾。白雾是什么呢?
Ⅰ.同学们作出猜想
猜想一:是小水滴。因为盐酸溶液中的水受热会汽化上升,在试管口_____(填物态变化名称)成小水滴。
猜想二:是盐酸小液滴。因为浓盐酸具有_____性,可能实验中使用的盐酸浓度过高,试管口就会形成盐酸小液滴。
同学们将干燥的蓝色石蕊试纸放在内有正在反应的镁条和盐酸的试管口,试纸变红,证明猜想二是合理的。
Ⅱ.小柯提出质疑
为什么刚才打开盛放实验所用盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白雾?
小柯联系反应时试管外壁很烫,于是猜想:白雾的形成可能与温度有关。
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后_____(填操作),试纸变红。
得出结论:这种盐酸浓度并不高,是因_____促使盐酸形成白雾。
【答案】滴加石蕊试液会变成蓝色 氢氧化钠 碳酸钠 碳酸氢钠饱和溶液的质量分数不可能达到10%,而碳酸钠溶液可以 CO2 将生成的气体通入澄清石灰水中,溶液变浑浊,说明该气体是二氧化碳 若滴加石蕊试液变成蓝色,则不含有硫酸钠 液化 挥发 加热试管,将干燥的蓝色石蕊试纸放在试管口 放热
【解析】
(一)[探究观察]NaCl、NaOH、Na2CO3和NaHCO3中只有氯化钠溶液为中性,而其余的溶液都显碱性,若溶质不是NaCl,则石蕊试液会变成蓝色;在进行操作②滴加稀盐酸时有无色无味的气体产生,说明不是氢氧化钠,因为氢氧化钠和盐酸反应无明显现象,故填:滴另石蕊试液会变成蓝色 氢氧化钠;
[探究结论]根据计算可以知道在20℃时饱和碳酸氢钠的质量分数为:![]() ×100%=8.8%,而题目中标注的溶液的质量分数为10%,所以这瓶试剂不可能的是碳酸氢钠溶液,而碳酸钠溶液的溶质质量分数可以等于10%,因此可能是碳酸钠,故填:碳酸钠 碳酸氢钠饱和溶液的质量分数不可能达到10%,而碳酸钠溶液可以;
×100%=8.8%,而题目中标注的溶液的质量分数为10%,所以这瓶试剂不可能的是碳酸氢钠溶液,而碳酸钠溶液的溶质质量分数可以等于10%,因此可能是碳酸钠,故填:碳酸钠 碳酸氢钠饱和溶液的质量分数不可能达到10%,而碳酸钠溶液可以;
[探究反思](1)假设碳酸钠成立,则碳酸钠和盐酸反应会产生二氧化碳,检验二氧化碳可以将气体通入石灰水,石灰水变浑浊,故填:CO2 将生成的气体通入澄清石灰水中,溶液变浑浊,说明该气体是二氧化碳;
(2)硫酸钠溶液为中性溶液,因此若滴加石蕊试液变成蓝色,则说明不含有硫酸钠,故填:若滴加石蕊试液变成蓝色,则不含有硫酸钠;
(二)Ⅰ、猜想一:水受热,由液态转化为气态,在试管口遇冷液化为液态的水,故填:液化;
猜想二:浓盐酸具有挥发性,挥发出来的氯化氢气体与空气中的水蒸气结合成盐酸的小液滴,故填:挥发;
Ⅱ、根据猜想可知,升高温度后,将干燥的蓝色石蕊试纸放在试管口观察是否变红色来检验,故填:加热试管,将干燥的蓝色石蕊试纸放在试管口;
得出结论:这种盐酸浓度并不高,是因放热促使盐酸形成白雾,故填:放热。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:初中化学 来源: 题型:
【题目】水是由氢、氧两种元素组成的化合物。这一结论是科学家们在大量实验的基础上得出的。
(1)实验室中常用锌粒和稀硫酸反应来制备氢气。请从下列装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为__(用接口处字母填写)。
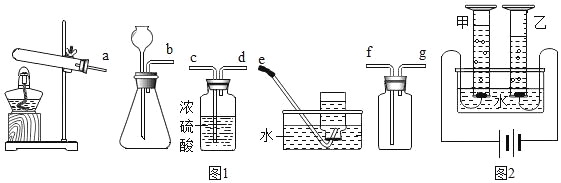
(2)研究氢气的燃烧实验是人们认识水组成的开始。
①氢气在点燃前一定要___;
②氢气在空气中燃烧时,若在火焰上方罩一冷而干燥的小烧杯,可观察到的现象是___。
(3)科学家们又用“电解法”证明了水的组成(装置如图所示,电极不与水及生成的气体反应)。电解时,水中需加入少量的NaOH,其作用是__。通电一段时间后,发现甲、乙两量筒中收集的气体体积比略小于1:2,其原因可能是__(写出一条即可)。
(4)拉瓦锡还用另一实验证明了水的组成。他让水蒸气通过一根烧红的铁质枪管,结果得到了氢气,同时枪管表面有黑色固体(磁铁矿的主要成分)生成。该反应的化学方程式为___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】三角烯(化学式为C22H14)应用于量子计算、量子信息处理和自旋电子学等领域。下列说法中正确的是( )
A. 三角烯属于有机高分子化合物
B. 三角烯中含有氢分子
C. 三角烯中碳、氢元素的质量比为11:7
D. 三角烯中碳元素的质量分数大于90%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸在工业上有着重要的用途。以黄铁矿(主要成分为FeS2)为原料生产硫酸的原理及工艺流程可简示如下:FeS2![]() SO2
SO2![]()
![]() H2SO4
H2SO4
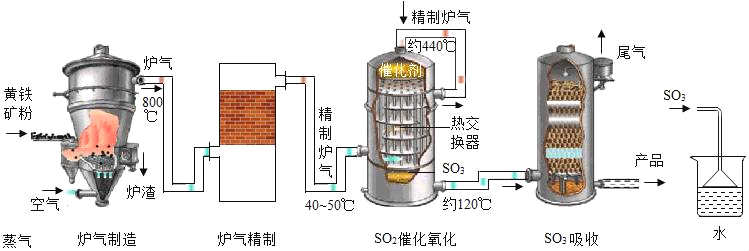
(1)工业生产过程中将矿石粉碎以及在吸收装置中液体由上而下形成喷雾状的目的是_____。
(2)在实验室模拟制硫酸时用如图装置吸收三氧化硫,除了达到与工业上相同的目的外,还可能考虑的因素是_____。
(3)工业上常用熟石灰来吸收尾气中的二氧化硫,请写出反应的化学方程式_____。(提示:生成物有一种是CaSO3)
(4)实验室中常用浓硫酸来配制稀硫酸。稀释时,正确操作是,_____,并用玻璃棒不断搅拌。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸氢钠(NaHCO3)俗称_____,是一种白色固体,易溶于水,水溶液湿碱性,它受热易分解(而Na2CO3受热不分解),化学方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O.阅读上文之后,与你熟悉的碳酸钠的知识进行对比,回答下列问题:
Na2CO3+CO2↑+H2O.阅读上文之后,与你熟悉的碳酸钠的知识进行对比,回答下列问题:
(1)碳酸氢钠的水溶液呈碱性,其pH_____7(填“>”“=”或“<”),如何通过实验证明这一点?_____.
(2)Na2CO3和NaHCO3有许多相似之处.按要求各举一例.
物理性质_____;化学性质_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明同学欲通过实验证明“二氧化锰是氯酸钾受热分解的催化剂”这一命题.他设计并完成了下表所示的探究实验:
实验操作 | 实验现象 | 实验结论或总结 | ||
各步骤结论 | 总结 | |||
实验 一 | 将氯酸钾加热至融化,伸入带火星的木条 | 木条复燃 | 氯酸钾受热分解产生氧气,但____________, 反应的文字表达式:___________________ | 二氧化锰是氯酸钾 受热分解的催化剂 |
实验二 | 加热二氧化锰,伸入带火星的木条 | 木条不复燃 | 二氧化锰受热不产生氧气 | |
实验三 | ____________ | 木条迅速复燃 | 二氧化锰能加快氯酸钾的分解 | |
(1)请你帮助小明同学填写上表中未填完的空格;
(2)在小明的探究实验中,实验一和实验二起的作用是_____;
(3)小英同学认为仅由上述实验不能完全得出表内“总结”,她补充设计了 两个方面的探究实验,最终完成了对“命题”的实验证明.
第一方面的实验操作中包含了两次称量,其目的是_____;
第二方面的实验是要_____(写实验目的).
第二方面的实验目的已经明确,如何设计实验加以证明?请写出实验步骤,现象,结论:
步骤:_____.
现象:_____.
结论:_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学用语表示的意义不正确的是:
A. 两个氢原子:2HB. 小苏打:NaHCO3
C. 2个铵根离子:2NH4+D. 氧化铜中氧元素显-2价:![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验课上,老师给了同学们一包红色粉末,该粉末可能是铜粉和氧化铁(Fe2O3)粉末中的一种或两种,为确定该粉末的成分,同学们进行了如下探究,请你参与其中并回答问题。
(己知氧化铁不溶于水,可溶于稀盐酸,生成氯化铁和水,溶液呈黄色)
(提出猜想)甲组:铜粉; 乙组:铜粉和氧化铁粉末;丙组:_____。
(设计实验)方案1:取少量红色粉末放入试管中,滴加足量的_____并振荡,若甲组猜想正确,则实验现象为_____。
方案2:取8g红色粉末放入硬质玻璃管中,先通入CO,然后用酒精喷灯加热一段时间(实验装置如图所
示),停止加热并继续通入CO至装置冷却。
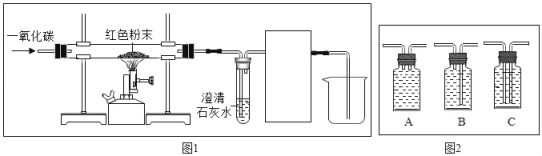
若乙组或丙组猜想正确,则试管内发生反应的化学方程式是_____。
实验时要先通CO再加热的原因是_____。实验结束是否需要将导管从澄清石灰水中取出,说明原因_____。
按方案2进行实验,当观察到硬质玻璃管中_____,则乙组猜想正确;等装置完全冷却到室温,称得硬质玻璃管内剩余固体质量为mg,则m的取值范围是_____。
(实验反思)如图虚线框内的装置是用于吸收CO2,并收集CO:请从如图(广口瓶内均为氢氧化钠溶液)中选择最合适的装置_____(填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】1869年门捷列夫发现了元素周期律,使得化学学习和研究变得有规律可循。如表列出的是1﹣18号元素的部分最高正化合价和最低负化合价。回答下列问题:
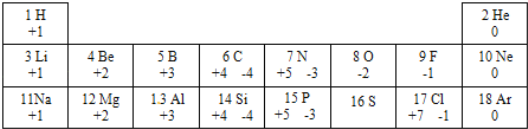
(1)金属锂、钠的化学性质有相似的原因是_____。
(2)推测16号元素最高正化合价为_____。地壳中含量最高的金属元素与非金属元素形成的化合物的化学式为_____。
(3)第三周期元素,从左到右,各原子随原子序数的增加,最外层电子数的递变规律是_____。
(4)从上表我们可以发现一些规律_____(写一条即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com